


| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
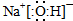 ,故答案为:
,故答案为: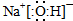 ;
;

科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈无色 | Fe+NO3-+4H+═Fe3++NO↑+2H2O Fe+2Fe3+═3Fe2+ |
| B | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | 避免晶体颗粒受热不均匀,发生崩裂而飞溅出蒸发皿 | |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | 溶液分层,上层呈橙红色,下层无色 | 避免上层液体再混入下层液体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、加少量水稀释 |
| C、加入少量盐酸 |
| D、加入少量AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A、M是芳香族化合物,它的分子式为C9H6O4 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、1mol M最多能与含有3mol NaOH的溶液发生反应 |
| D、在一定条件下能发生取代、加成、水解、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g乙醇中含有的化学键数为7NA |
| B、1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C、1mol OH-和1mol-OH(羟基)中含有的质子数均为9NA |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com