
| A、46g乙醇中含有的化学键数为7NA |
| B、1mol氯气和足量NaOH溶液反应转移电子数为2NA |
| C、1mol OH-和1mol-OH(羟基)中含有的质子数均为9NA |
| D、10L 0.1mol?L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )
如图装置中发生反应的离子方程式为:Cu+2H+=Cu2++H2↑,下列说法正确的是( )| A、a、b不可能是同种材料的电极 |
| B、该装置可能是原电池,电解质溶液为稀盐酸 |
| C、该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸 |
| D、该装置可能是电解池,电解质溶液为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液:K+、Ca2+、HCO3-、NO3- |
| B、能使淀粉碘化钾试纸变蓝的溶液:K+、I-、SO42-、NO3- |
| C、使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- |
| D、能够溶解Al且放出H2的溶液:NH4+、K+、Br-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
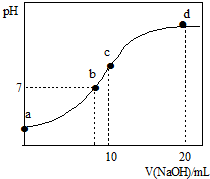 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B两元素能形成多种化合物 |
| B、D、E两元素的最高价氧化物对应的水化物可相互反应 |
| C、C的气态氢化物的稳定性一定大于F的气态氢化物 |
| D、C、F两种元素可以形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 反应能量变化 | 放出αkJ热量 | 吸收19.6kJ热量 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com