
【题目】用惰性电极电解CuCl2和CuSO4的混合溶液(物质的量浓度均为0.1mol/L)500 mL,当阴极析出4.8g固体时,在阳极可得到标准状况下的气体体积为( )
A. 1.68LB. 1.4LC. 3.36LD. 2.24L
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
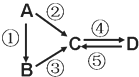
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )

A. 4︰1B. 3︰1C. 2︰1D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
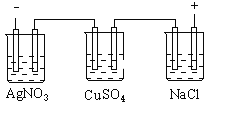
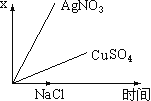
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属有M沉淀出来,

请回答下列问题:
(1)其中P是______极,B是______极。
(2)写出A极、B极、C极、D极上的电极反应式。
A极上电极反应式为____________________________________________________。
B极上电极反应式为____________________________________________________。
C极上电极反应式为____________________________________________________。
D极上电极反应式为____________________________________________________。
(3)当电路中通过2.4081022个电子时,B极上沉淀出1.28gM,则M的相对原子质量为__________。
(4)如果将电池的正负极交换,接入原电路通过1.2041022个电子时,则 B极上的电极反应式为____________________________________________,A极上析出______ g ______(填物质名称),甲池的总反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 mL 2 mol·L-1Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1906年,哈伯在60℃高温、200兆帕高压的条件下,用锇(Os)作催化剂,首次成功得到了氨,但产率较低。随着科学的进步以及科学家们对催化剂的研究改进,现在工业上普遍采用铁触媒(主要成分为Fe3O4,助催化剂:K2O、Al2O3、CaO、MgO、CoO等)做合成氨的催化剂,大大提高了合成氨的产率。回答下列问题:
(1)已知元素Co(钴)的原子核内有27个质子,则该元素基态原子价电子排布式为___。
(2)元素Fe的基态原子核外未成对电子数为___;Fe2+与Fe3+相比较,___更稳定。
(3)C、N、O处于同一周期,其中第一电离能最大的___,电负性最大的是___,它们与氢形成的简单氢化物沸点从高到低的顺序为___。
(4)NH3分子中N原子的杂化方式为___;氨气极易溶于水(溶解度1:700),除了氨气能与水发生反应外,还有两个原因分别是___、___。
(5)我国长征系列运载火箭使用的液态燃料主要是偏二甲肼[结构简式:(CH3)2NNH2,可看作是肼(NH2NH2)中同一氮原子上的两个氢原子被甲基取代]和四氧化二氮,燃烧时发生反应:(CH3)2NNH2+2N2O4=2CO2+4H2O+3N2。当该反应消耗1molN2O4时将形成___molπ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤:
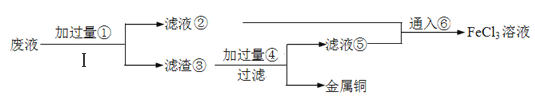
(1)步骤Ⅰ的操作名称:________;所需玻璃仪器:_________、_________、__________。
(2)写出FeCl3溶液与铜箔发生反应的离子方程式:______________________。
(3)检验废腐蚀液中是否含有Fe3+所需试剂名称:___________、实验现象:__________。
(4)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:________________,此转化的化学方程式为:______________________________。
(5)写出③中所含物质:_________⑥发生反应的离子方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com