
【题目】铬是一种银白色金属,化学性质稳定,在化合物中常见![]() 、
、![]() 和
和![]() 价等价态。工业上以铬铁矿
价等价态。工业上以铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠![]() 已知
已知 ![]() 是一种强氧化剂
是一种强氧化剂![]() ,其主要工艺流程如下:
,其主要工艺流程如下:
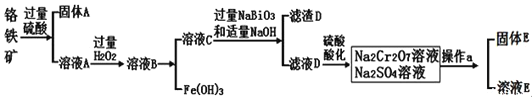
查阅资料得知:常温下,![]() 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将![]() 转化为
转化为![]()
回答下列问题:
![]() 工业上常采用热还原法制备金属铬,写出以
工业上常采用热还原法制备金属铬,写出以![]() 为原料,利用铝热反应制取金属铬的化学方程式_______________。
为原料,利用铝热反应制取金属铬的化学方程式_______________。
![]() 酸化滤液D时,不选用盐酸的原因是_____________。
酸化滤液D时,不选用盐酸的原因是_____________。
![]() 固体E的主要成分是
固体E的主要成分是![]() ,根据如图分析操作a为________________、____________、洗涤、干燥。
,根据如图分析操作a为________________、____________、洗涤、干燥。
![]() 已知含
已知含![]() 价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的![]() 。
。
![]()
![]() 的化学性质与
的化学性质与 ![]() 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________![]() 用离子方程式表示
用离子方程式表示![]() ;
;
![]() 下列溶液中可以代替上述流程中
下列溶液中可以代替上述流程中![]() 溶液最佳的是___________
溶液最佳的是___________![]() 填选项序号
填选项序号![]() ;
;
A ![]() 溶液
溶液 ![]() 浓
浓![]()
![]() 酸性
酸性![]() 溶液
溶液 ![]() 溶液
溶液
![]() 上述流程中,每消耗
上述流程中,每消耗![]() 转移
转移![]() ,则加入
,则加入![]() 溶液时发生反应的离子方程式为_____________。
溶液时发生反应的离子方程式为_____________。
![]() 某厂废水中含
某厂废水中含![]() 的
的![]() ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 ![]() 的化合价为
的化合价为![]() ,Fe的化合价依次为
,Fe的化合价依次为![]() 、
、![]() 。欲使1L该废水中的
。欲使1L该废水中的 ![]() 完全转化为
完全转化为![]() 。理论上需要加入________
。理论上需要加入________![]() 。
。
![]() 已知
已知![]() 摩尔质量为
摩尔质量为![]()
【答案】
![]() 会氧化
会氧化![]() 生成氯气,造成污染 蒸发结晶 趁热过滤
生成氯气,造成污染 蒸发结晶 趁热过滤 ![]()
![]()
![]()
![]()
【解析】
根据流程:铬铁矿![]() 主要成分为
主要成分为![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() 用过量的硫酸酸浸,
用过量的硫酸酸浸,![]() 不溶,过滤,固体A为
不溶,过滤,固体A为![]() ,溶液A为含有
,溶液A为含有![]() 、
、![]() 、
、![]() 的酸性溶液,加入过量过氧化氢氧化
的酸性溶液,加入过量过氧化氢氧化![]() 为
为![]() ,调节pH除去
,调节pH除去![]() ,溶液C含有
,溶液C含有![]() 、
、![]() ,加入过量
,加入过量![]() ,NaOH,在碱性条件下,能将
,NaOH,在碱性条件下,能将![]() 转化为
转化为![]() ,
,![]() 沉淀,滤液D含有
沉淀,滤液D含有,加入硫酸酸化得到含有的
![]() 和
和![]() 的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到
的溶液,蒸发结晶,趁热过滤、洗涤、干燥得到![]() ,以此解答此题。
,以此解答此题。
根据上述分析可知:
![]() 利用铝热反应制取金属铬的化学方程式:
利用铝热反应制取金属铬的化学方程式: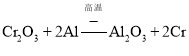 ;
;
故答案为: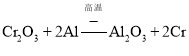 ;
;
![]() 是一种强氧化剂,
是一种强氧化剂,![]() 会氧化
会氧化![]() 生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
生成氯气,造成污染,故酸化滤液D时,不选用盐酸;
故答案为:![]() 会氧化
会氧化![]() 生成氯气,造成污染;
生成氯气,造成污染;
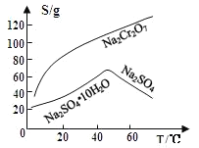
![]() 由图2可知
由图2可知![]() 的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
故答案为:蒸发结晶;趁热过滤;
![]() 的化学性质与
的化学性质与![]() 相似,如果氢氧化钠过量
相似,如果氢氧化钠过量![]() 会溶解,发生离子方程式为:
会溶解,发生离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 可以代替上述流程中
可以代替上述流程中![]() 溶液,需要具有还原性,能还原重铬酸根离子;
溶液,需要具有还原性,能还原重铬酸根离子;
A.![]() 溶液中亚铁离子具有还原性,可以还原
溶液中亚铁离子具有还原性,可以还原![]() 离子,但又引入新的杂质离子铁离子,故A不符合;
离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓![]() 具有强氧化性,不能表现还原性,不能还原
具有强氧化性,不能表现还原性,不能还原![]() ,故B不符合;
,故B不符合;
C.酸性![]() 是强氧化剂不能还原
是强氧化剂不能还原![]() ,故C不符合;
,故C不符合;
D.![]() 溶液中亚硫酸根离子具有还原性,可以还原
溶液中亚硫酸根离子具有还原性,可以还原![]() ,故D符合;
,故D符合;
故答案为:D;
![]() 每消耗
每消耗![]() 转移
转移![]() ,
,![]() ,
,![]() ,依据氧化还原反应电子守恒配平书写,
,依据氧化还原反应电子守恒配平书写,![]() ,
,![]() ,得到的氧化还原反应的离子方程式为
,得到的氧化还原反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
![]() 根据
根据![]() 中,Cr:
中,Cr:![]() :
:![]() :5;故有
:5;故有![]() ,故质量为
,故质量为![]() ;
;
故答案为:![]() 。
。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
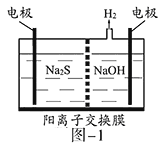
(1)将烧碱吸收H2S后的溶液加入到如题图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-=S(n—1)S+ S2-=Sn2-。
①写出电解时阴极的电极反应式:__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成_____________。
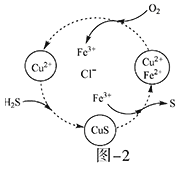
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如题图—2所示。
①在图示的转化中,化合价不变的元素是___________。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为_______________。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________________。
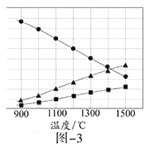
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题图—3所示,H2S在高温下分解反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮与氟、硫、镓三种元素之间可以形成具有特殊组成和性质的化合物。回答下列问题:
(1)基态镓原子电子排布式为___;硫原子核外有___种运动状态不同的电子。
(2)第一电离能符号为I1,I1(N)___I1(S)(填“>”或“<”)。
(3)NSF(N=S-F)与SNF(S=N-F)互为同分异构体。
①关于NSF与SNF的说法正确的是___ (填标号)。
A.二者均含有极性键和非极性键
B.二者均含有σ键与π键
C.二者均为非极性分子
D.二者与SO2均互为等电子体
②NSF发生聚合生成三聚分子A( ),SNF发生聚合生成三聚分子B(
),SNF发生聚合生成三聚分子B(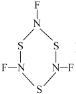 ),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。
),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。
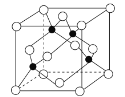
(4)氮化镓是直接隙半导体材料,具有易发光、电光转化效率高的特点。某种立方晶型氮化镓晶胞如图所示。(图中“O”与“●”大小比例关系符合二者原子实际大小比例关系)
①图中“●”表示的原子为___ (填元素符号)。
②已知NA为阿伏加德罗常数的值,晶胞的密度为dg·cm-3。则晶胞的边长为___ nm。两个距离最近的氮原子之间的距离为___ nm。(均用含d和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是

A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如图:
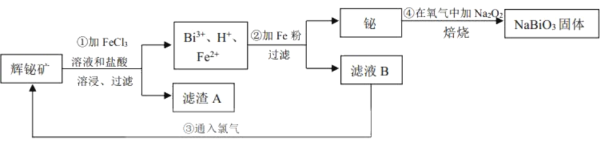
己知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有___(填标号)。
a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是___,滤渣A的主要成分为___(填化学式)。
(3)反应④的化学方程式为___。
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO![]() ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要___。
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为___%(结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
OH-+H+ ,在25℃、35℃时其离子积分别为K(25℃)=1×10-14 、K(35℃)=2.1×10-14 。则下列叙述中正确的是( )
A.在35℃,纯水中C(H+)>C(OH-)
B.水的电离度α(25℃)>α(35℃)
C.25℃时,向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
D.某温度下纯水中C(H+) 为2×10-7mol/L,则此时的C(OH-) 也为2×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com