
【题目】用下列实验装置进行相应的实验,不能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质。
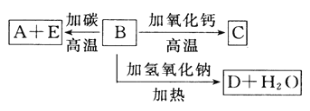
请填空:
(1)形成单质A的原子的结构示意图为______,它的最高化合价为______。
(2)B的化学式(分子式)为______,B和碳反应生成A和E的化学方程式是____________。
(3)C的化学式(分子式)为___________,D的化学式(分子式)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。回答下列问题:
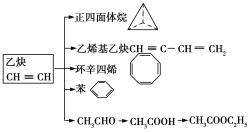
(1)正四面体烷的二氯取代产物有_____种。
A.1种 B.2种 C.3种 D.4种
(2)关于乙烯基乙炔分子的说法错误的是____(填字母符号)。
A.能使酸性KMnO4溶液褪色
B.1 mol乙烯基乙炔最多能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
E.乙烯基乙炔分子中的所有原子一定都共平面
(3)环辛四烯的分子式为____,写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:_______
(4)下列属于苯的同系物的是____(填字母符号)。
A.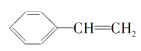 B.
B.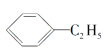
C.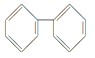 D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时,SO2 转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是 _________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2 的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______,发生的电极反应为______;
②电池正极发生的电极反应为______;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____,反应的化学方程式为______
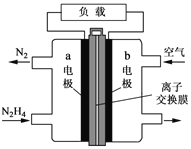
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为 ______ ,正极反应式为 ____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆70周年大典上,放飞的气球由可降解材料制作,内充的气体是比氢气安全的氦气。下列关于氦的说法正确的是( )
A.氦气比氢气活泼B.氦气的密度比空气大
C.氦气的分子式为He2D.氦原子最外层电子数为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 青铜、碳素钢和石英都是合金
B. 陶瓷、玻璃和水泥都是无机非金属材料
C. 乙醇与乙醛互为同分异构体,都能发生银镜反应
D. 油脂皂化和蛋白质水解都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)又称肼,是一种良好的火箭燃料,与适量氧化剂混合可组成液体推进剂,无水N2H4液体有微弱氨气的气味。
(1)N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-622 kJ/mol,试计算1 mol气态肼与二氧化氮完全反应时放出的热量为_______。
(2)在加热条件下,液态肼可还原新制的Cu(OH)2制备纳米级Cu2O,并产生无污染气体,试写出该反应的化学反应方程式_______________________________。
(3)以气态肼为原料的碱性燃料电池的总反应为N2H4+O2=N2+2H2O,放电时负极的反应方程式为______________________________
(4)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程 N2H4+H2O![]() N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
N2H5++OH-,试写出第二步电离过程____________________________。常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中水电离出的c(H+)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是常见的无机强酸,是重要的化工原料。实验室模拟硝酸的制备可用以下装置,其中a为一个可持续鼓入空气的橡皮球,b、c为止水夹。

(1)实验开始前,应检验装置的气密性,请写出检验A~E装置(不必考虑a)的气密性方法________________。
(2)装置A中发生反应的化学方程式为___________。装置C中浓硫酸的作用是__________。
(3)实验进行一段时间,待制备一定量硝酸后,停止加热A和B中装置,但仍要通过a鼓入一定量的空气,该操作的目的是____________________。
(4)若F装置中所选用试剂为酸性KMnO4溶液,请写出F装置处理NO尾气的离子方程式:_____________________。
(5)欲使A中产生的氨气尽可能转化为硝酸,理论上氨气与鼓入空气的最佳比例为_______。
(6)实验完毕后,取E中的溶液,加入几滴酚酞溶液,用0.10 mol/L的NaOH标准液滴定,发现加入过量标准液后仍无现象,试解释没有观察到滴定终点的原因_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见金属A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间的转化关系如图所示,请根据以上信息回答下列问题:
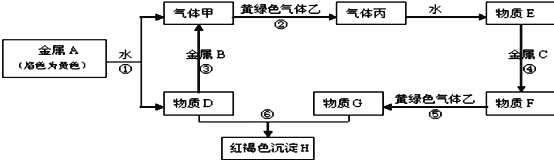
(1)写出下列物质的化学式:B _______ F______
(2)写出下列反应离子方程式:
反应⑤________________
反应⑥_______________
(3)实验室制取气体乙时,先将气体生成物通过 _______以除去_______
(4)在反应MnO2 + 4HCl(浓) △ MnCl2 + Cl2↑+ 2H2O中,浓盐酸体现了_____ 性和__________性,参加反应的氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com