
【题目】(16分)磷的单质及其化合物在生产、生活中有着重要的用途。回答下列问题:
(1)直链低聚磷酸盐的化学式可表示为M(n+2)PnOx(M为+1价金属离子),则x= (用n表示)。
(2)H3PO2及NaH2PO2具有较强还原性,均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①H3PO2是一元弱酸,写出其电离方程式: 。NaH2PO2水溶液显_________(填“酸性”、“中性”、或者“碱性”)。
②H3PO2中,磷元素的化合价为_____,在碱性条件下,次磷酸盐可用于化学镀银,配平反应的离子方程式: ![]() + Ag+ +
+ Ag+ + ![]() + Ag↓ + 。
+ Ag↓ + 。
(3)H3PO2可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③得到1 mol H3PO2的同时,阴极室制得NaOH质量为________g。
(4)含磷(主要为H3PO4、磷酸盐等)废水需加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(PO43)=4×107 mol·L1,则溶液中c(Ca2+)= mol·L1。(已知Ksp[Ca3(PO4)2]=2×1029)
【答案】除标注外,其余每空均2分
(1)3n+1
(2)①H3PO2![]() H++
H++![]() 碱性(1分)
碱性(1分)
②+1(1分) 1 4 6OH 1 4 4H2O
(3)①4OH4eO2↑+2H2O
②阳极室的H+穿过阳膜扩散至产品室,原料室的![]() 穿过阴膜扩散至产品室,二者反应生成H3PO2
穿过阴膜扩散至产品室,二者反应生成H3PO2
③40
(4)5×106
【解析】
试题分析:
(1)根据正负化合价代数和为0可得结果;
(2)①H3PO2是一元弱酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2![]()
![]() +H+;由于H3PO2是一元弱酸,所以NaH2PO2为一元强碱和一元弱酸形成的正盐,所以该盐溶液由于H2PO2发生水解呈碱性。
+H+;由于H3PO2是一元弱酸,所以NaH2PO2为一元强碱和一元弱酸形成的正盐,所以该盐溶液由于H2PO2发生水解呈碱性。
②H3PO2中,元素正负化合价为0,其中氢元素为+1价,氧元素为2价,则P元素的化合价为+1价;该反应是氧化还原反应,同时也是离子反应,根据电子守恒、电荷守恒及原子守恒,可得反应的方程式是:![]() +4Ag++6OH
+4Ag++6OH![]() +4Ag↓+4H2O。
+4Ag↓+4H2O。
(3)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH4eO2↑+2H2O;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的![]() 穿过阴膜扩散至产品室,二者反应生成H3PO2,即
穿过阴膜扩散至产品室,二者反应生成H3PO2,即![]() +H+H3PO2;
+H+H3PO2;
③阴极上氢离子得电子发生还原反应,电极反应式为2H2O+2eH2↑+2OH,当得到1 mol H3PO2的同时转移1 mol H+,即反应中转移电子数为1 mol,则阴极室生成1 mol NaOH,质量为40 g;
(4)根据Ksp[Ca3(PO4)2]= c2(![]() )×c3(Ca2+)=2×1029,因c(
)×c3(Ca2+)=2×1029,因c(![]() )=4×107 mol·L1,则c(Ca2+)=5×106 mol·L1。
)=4×107 mol·L1,则c(Ca2+)=5×106 mol·L1。


科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
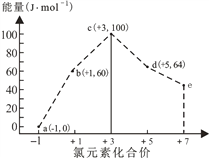
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为20kJ·mol-1
C. b→a+d反应的热化学方程式为3ClO-(aq)=
ClO3-(aq)+2Cl-(aq) △H=-116kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为16:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,该反应是一个可逆反应。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,该反应是一个可逆反应。若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )


A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下若由a点达到平衡,可以采取增大压强的方法
D. 在达到平衡的过程中,c点v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素是第一个人工合成的有机物,下列关于尿素的叙述不正确的是( )
A.尿素是一种氮肥B.尿素是人体新陈代谢的一种产物
C.尿素是一种有机物D.尿素中含NH4+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol;
CO(g)+![]() O2(g)===CO2(g) ΔH=-282.9 kJ/mol。
O2(g)===CO2(g) ΔH=-282.9 kJ/mol。
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中的H2和CO的物质的量之比为( )
A. 2∶1 B. 1∶2 C. 1∶1 D. 2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com