
【题目】实验室常用二氧化锰和浓盐酸共热的方法制取氯气。根据要求回答下列问题。
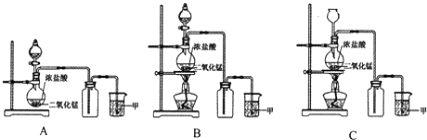
(1)A、B、C三套装置中,应选用的装置是____________(选填“A”、“B”、“C”);
(2)写出制取氯气的化学方程式_________________________________________。
(3)为了防止氯气污染环境,图中溶液甲中发生的化学反应方程式___________________。
(4)由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是_____________________,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明) ___________________________________________________ 。
【答案】B MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O==CaCO3+2HClO 2HClO
MnCl2+Cl2↑+2H2O Cl2+2NaOH==NaCl+NaClO+H2O 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O==CaCO3+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)实验室常用二氧化锰和浓盐酸共热的方法制取氯气,为防止浓盐酸挥发,需要用分液漏斗,不用长颈漏斗,因此选择装置B;综上所述,本题选B。
(2)二氧化锰和浓盐酸共热,反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;综上所述,本题答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;综上所述,本题答案是:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)氯气有毒,需要进行尾气处理,一般用氢氧化钠溶液吸收氯气,图中溶液甲中发生的化学反应方程式:Cl2+2NaOH=NaCl+NaClO+H2O;综上所述,本题答案是:Cl2+2NaOH=NaCl+NaClO+H2O。
(4)工业上制备漂白粉是利用石灰乳和氯气反应生成氯化钙、次氯酸钙和水, 反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ;漂白粉成分为氯化钙和次氯酸钙的混合物,有效成分为次氯酸钙,漂白粉长期暴露在空气中会逐渐失效,是因为次氯酸钙和空气中的二氧化碳、水反应生成碳酸钙沉淀和次氯酸, Ca(ClO)2+CO2+H2O=CaCO3+2HClO,次氯酸见光分解生成氧气和盐酸, 2HClO![]() 2HCl+O2↑;漂白粉失效;综上所述本题答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O; Ca(ClO)2+CO2+H2O=CaCO3+2HClO, 2HClO
2HCl+O2↑;漂白粉失效;综上所述本题答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O; Ca(ClO)2+CO2+H2O=CaCO3+2HClO, 2HClO![]() 2HCl+O2↑。
2HCl+O2↑。


科目:高中化学 来源: 题型:
【题目】皮蛋是人们喜爱的食物,某同学查阅资料得知制作皮蛋的料泥中含有NaOH和Na2CO3,为检验其酸碱性,将料泥溶解过滤后,向滤液中加入
A. 稀硫酸 B. 酚酞试液 C. KNO3溶液 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为 __________ g,假设广口瓶里生成一种正盐,其质量为 __________ g;
(2)生成的水中氢元素的质量为 __________ g;
(3)生成的二氧化碳中碳元素的质量为 __________ g;
(4)该燃料中碳元素与氢元素的物质的量之比为 __________ ;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为 __________ ,结构简式为 __________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJmol-1,如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A. 电极a上发生的电极反应式为:H2S - 2e- = S+2H+
B. 电池工作时,电流从电极b经过负载流向电极a
C. 电路中每流过1 mol电子,电池内部释放158 kJ的热能
D. 每11.2 LH2S参与反应,有1 mol H+经固体电解质膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
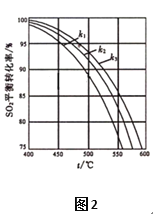
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)可用作有机合成的氯化剂和催化剂,实验室制取POCl3并测定产品含量的实验过程如下:
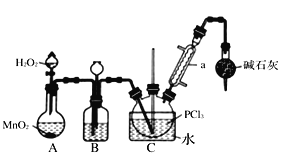
I.制备POCl3可用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略)及相关信息如下。
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其 他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)装MnO2的仪器名称是__________;干燥管的作用为_________________________。
(2)装置B中的液体药品是_____;装置B有三个作用,分别为______________________。
(3)三氯化氧磷还可由三氯化磷与水、氯气反应制备。此方法生产三氯化氧磷的化学方程式为____________________________________。
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待反应器中液体冷却到室温,准确称取一定质量的 POCl3产品(杂质不含氯元素),置于盛有100.00 mL蒸馏水的烧杯中摇动至完全水解,将水解液配成200.00 mL溶液
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 1.5 mol/L AgNO3标准溶液
③加入少量硝基苯,用力摇动,静置
④加入指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去15.00 mL KSCN溶液。
(4)选择的指示剂为___________。
(5)测得产品中n(POCl3)= ___________________________。(已知:磷酸银可溶于酸)
(6)已知Ksp(AgCl)> Ksp(AgSCN),步骤③的目的是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物可以通过光合作用在体内合成有机物,被称为生物质(以淀粉为代表),具有广阔的应用前景。已知生物质的主要转化途径及主要产物如图所示:
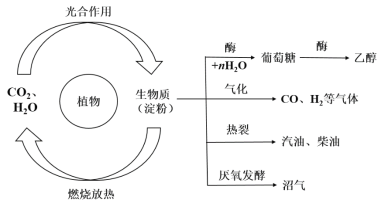
请回答:
(1)农村燃烧沼气供能的反应类型为下列的______。
A.吸热反应 B.放热反应 C.氧化还原反应 D.非氧化还原反应
(2)写出葡萄糖的化学式________________,上图由葡萄糖得到乙醇的反应中另一种气体产物的结构式为__________________。
(3)下列说法不正确的是______。
A.生物质中的能量本质上来自于太阳能
B.生物质气化产物中所含的能量既属于化学能,又属于生物质能
C.上图中生物质的所有转化均为化学反应
D.直接燃烧生物质是一种高效利用能源的方式
(4)已知18 g的葡萄糖固体被氧气完全氧化生成两种气体产物时放出热量254 kJ,写出该反应的热化学方程式_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com