
【题目】下列反应中,属于取代反应的是
A. 乙醇与钠反应生成乙醇钠B. 乙烯燃烧生成二氧化碳和水
C. 乙醇与乙酸反应生成乙酸乙酯D. 乙醇与氧气反应生成乙醛
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在一定温度和压强下,CO(g)+2H2(g)CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO,H2、CH3OH的浓度之比为1:2:1
E.CH3OH,CO,H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的+1价化合物如Cu2O、CuCl都是重要的化工产品,研究它们的制备及其性质具有重大的现实意义.
(1)Cu2O是一种具有独特光、磁特性的红棕色p型半导体材料.
(i)工业上可以用新制Cu(OH)2悬浊液与液态肼(N2H4)反应制备Cu2O,同时放出N2 , 下列对应的化学反应方程式:
(ii)已知常温下,溶液中的Cu+易在酸性条件下发生反应:2Cu+=Cu2++Cu.写出稀硫酸与Cu2O反应的离子方程式
(2)氯化亚铜(CuCl)微溶欲水,不溶于酒精,在潮湿空气中易水解氧化.某课外小组以某工业废渣(主要成分为硅,铜,碳等)为原料制备CuCl的流程示意图如图:
(i)“滤渣”的主要成分为(填化学式).
(ii)“还原”过程中SO32﹣将Cu2+还原为CuCl,请写出反应的例子方程式: , 亚硫酸钠需适当过量,目的有 .
(iii)操作Ⅰ和操作Ⅱ所用的玻璃仪器为 . 操作Ⅲ包括对滤饼的醇洗,干燥,使用无水乙醇代替水进行洗涤的优点是
(iv)CuCl是共价化合物,经测定其蒸气对H2的相对密度为99.5,测它的准确的分子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若氖原子质量是ag,12C的原子质量是bg,NA是阿伏伽德罗常数的值,下列说法不正确的是( )
A.该氖原子的相对原子质量是12 ![]()
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量是 ![]() mol
mol
D.Wg该氖原子所含质子数是10W/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表各组物质中,不能通过一步反应实现如图所示转化的是( )
选项 | X | Y | Z |
A | Fe | FeCl3 | FeCl2 |
B | NH4Cl | NH3 | NO |
C | C | CO | CO2 |
D | Al2O3 | AlCl3 | Al(OH)3 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】850℃时反应A(g)+B(g) ![]() C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
C(g)+D(g)△H<0,该温度下平衡常数K=l.t℃时,在一定体积的容器中,通入一定量的A和B发生化学反应,各物质浓度随时间变化如下表:t℃时物质的浓度(molL﹣1)变化
时间/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(1)计算t℃该化学反应的平衡常数:
(2)t℃850℃(填大于、小于或等于).判断依据是
(3)反应在4min~5min之间,平衡(填“向左”、“向右”或“不”)移动,可能的原因是
a.增加A的浓度 b.增加D的浓度 c.加压 d.使用催化剂
(4)某温度下反应C(g)+D(g)A(g)+B(g)的平衡浓度符合c(C)c(D)=2c(A)c(B),则此时的温度850℃(填大于、小于或等于).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( ) 
A.分子式为C15H24O2
B.属子芳香族化合物
C.能发生取代反应和加成反应
D.分子中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下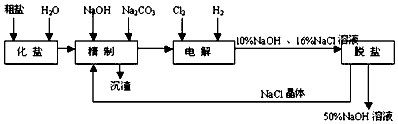
(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是 , .
(2)如果粗盐中SO42﹣含量较高,必须添加钡式剂除去SO42﹣ , 该钡试剂可以是
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
(3)电解过程中所发生反应的化学方程式为 , 与电源正极相连的电极附近产生的气体是 , 检验该气体可使用试纸,现象是试纸变为色.
(4)氯碱工厂生产的氯气和氢气可以进一步用于生产盐酸,主要过程如下: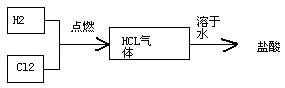
其中关键的一步为氯气和氢气在燃烧管口燃烧生成HCl,氯气有毒,应采取的措施是 . 合成盐酸厂要求合成气中的HCl的含量要大于97%,试用最简便的方法进行分析是否含量大于97% .
(5)氯碱工厂生产的氯气和氢氧化钠溶液可以用于制取“84消毒液”,反应的化学方程式为 .
(6)某同学欲证明盐酸与氯化氢气体性质不同,他分别向A、B、C三支洁净试管中各放入一片干燥的蓝色石蕊试纸,然后往A试管内加入盐酸,试纸显色,往B试管中通入干燥的氯化氢气体,试纸显色.最后向C试管中加入物质(填化学式),他之所以加入这种物质的理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com