
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在一定温度和压强下,CO(g)+2H2(g)CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO,H2、CH3OH的浓度之比为1:2:1
E.CH3OH,CO,H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).
【答案】
(1)![]() ;正向移动;增大
;正向移动;增大
(2)BE
(3)128.8;<
【解析】解:(1)开始时c(CO)= ![]() =5amol/L、c(H2)=
=5amol/L、c(H2)= ![]() =10amol/L,反应的c(CO)=5amol/L×60%=3amol/L,
=10amol/L,反应的c(CO)=5amol/L×60%=3amol/L,
CO(g) | + | 2H2(g) | CH3OH(g) | △H=﹣128.8kJ/mol | ||
开始(mol/L) | 5a | 10a | 0 | |||
反应(mol/L) | 3a | 6a | 3a | |||
平衡(mol/L) | 2a | 4a | 3a |
该反应的化学平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
此时c(CO)=2amol/L+ ![]() =7amol/L、c(H2)=4amol/L+
=7amol/L、c(H2)=4amol/L+ ![]() =14amol/L、c(CH3OH)=3amol/L+
=14amol/L、c(CH3OH)=3amol/L+ ![]() =8amol/L,浓度商=
=8amol/L,浓度商= ![]() =
= ![]() <
< ![]() ,所以平衡正向移动,但再次达到平衡浓度大于原来平衡浓度,
,所以平衡正向移动,但再次达到平衡浓度大于原来平衡浓度,
所以答案是: ![]() ;正向移动;增大;(2)A.反应前后气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能据此判断平衡状态,故A错误;
;正向移动;增大;(2)A.反应前后气体总质量不变、容器体积不变,所以混合气体的密度始终不变,不能据此判断平衡状态,故A错误;
B.反应前后气体的总质量不变但物质的量减小,所以反应前后混合气体的平均相对分子质量增大,当混合气体相对分子质量不变时,正逆反应速率相等,反应发达平衡状态,故B正确;
C.v逆(H2)=2v正(CO)时该反应达到平衡状态,所以2v逆(H2)=v正(CO)时没有达到平衡状态,故C错误;
D.容器内CO、H2、CH3OH的浓度之比为1:2:1时该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故C错误;
E.CH3OH、CO、H2的浓度都不再发生变化时,正逆反应速率相等,反应达到平衡状态,故E正确;
故选BE; (3)甲、乙是等效平衡,丙等效为在乙的基础上增大压强,
生成1molCH3OH的能量变化为128.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1﹣n),故a+b=128.8;
甲、乙处于相同的平衡状态,则α1+α2=1,比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)CO(g)+2H2(g),平衡向生成甲醇的方向移动,所以a1+a3<1,
所以答案是:128.8;<.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质或离子在指定分散系中能大量共存的是( )
A.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.空气中:H2、HCl、NO、NH3
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位.炼铁高炉中发生的关键反应如下:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ ![]() O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的燃烧热为;写出其热化学方程式 .
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为 .
(3)炼制1t(吨)含铁96%的生铁所需焦炭的理论用量是t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,有甲、乙两种实验方案如图1:已知:3I2+6NaOH=5NaI+NaIO3+3H2O.请回答: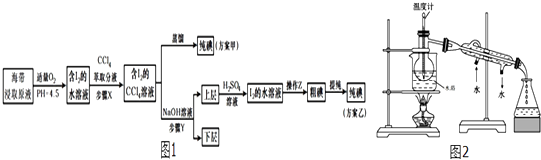
(1)步骤X使用分液漏斗前须检漏,检漏方法为 .
(2)用图所示装置进行蒸馏.指出如图所示实验装置 中的任意两处错误:① .
(3)进行上述操作时,使用水浴加热更好的原因是;最后碘晶体在里聚集.
(4)下列有关步骤Y的说法,正确的是 .
A.应控制 NaOH 溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH 溶液可以由乙醇代替
(5)方案乙在上层溶液中加入H2SO4溶液得到I2的水溶液发生的反应方程式是:;
(6)操作Z的名称是 .
(7)工业中采用方案乙从海带中提取碘,方案甲中采用蒸馏不合理,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
A. 乙醇与钠反应生成乙醇钠B. 乙烯燃烧生成二氧化碳和水
C. 乙醇与乙酸反应生成乙酸乙酯D. 乙醇与氧气反应生成乙醛
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com