
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
【答案】C
【解析】解:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol﹣0.8mol=0.4mol,v(CO)= ![]() =
= ![]() mol/(Lmin),速率之比等于化学计量数之比计算v(H2)=v(CO)=
mol/(Lmin),速率之比等于化学计量数之比计算v(H2)=v(CO)= ![]() mol/(Lmin),故A错误;
mol/(Lmin),故A错误;
B、t1min内参加反应的CO的物质的量为1.2mol﹣0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol﹣0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故CO的转化率为 ![]() ×100%=33.3%,故B错误;
×100%=33.3%,故B错误;
C、t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol﹣0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算7平衡常数,则k= ![]() =1,故C正确
=1,故C正确
D、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol﹣0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,根据化学方程式可知,则生成的n(CO2)=0.4mol,故D错误;
故选C.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组的同学欲探究测定草酸晶体(H2C2O4xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 10.02 |
第二次 | 25.00 | 0.22 | 11.32 |
第三次 | 25.00 | 1.56 | 11.54 |
请回答:
(1)滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志可以是 .
(3)通过上述数据,计算出x= .
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标况下,22.4L的Cl2与足量水反应中电子转移了2NA
B.0.1mol/LK2SO4溶液中含有0.2NA个阳离子
C.常温常压下,22.4LO2气体的分子数小于NA
D.20g D2O所含的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源.
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
写出由CH4和O2制取CH3OH(g)的热化学方程式: .
(2)甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)= . 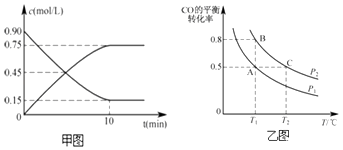
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生上述反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如乙图所示.
能判断该反应达到化学平衡状态的是(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若KOH溶液足量,写出燃料电池负极的电极反应式:
(5)如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 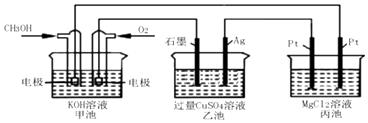
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).
(1)在一定温度和压强下,CO(g)+2H2(g)CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).
若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)判断该反应达到平衡状态的依据是(填字母序号).
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.2v逆(H2)=v正(CO)
D.容器内CO,H2、CH3OH的浓度之比为1:2:1
E.CH3OH,CO,H2的浓度都不再发生变化
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 | 1 mol CH3OH | 2 mol CH3OH | |
平衡 | 反应能量变化的绝对值(kJ) | a | b | c |
反应物转化率 | α1 | α2 | α3 | |
则a+b=;a1+a3(填“<”、“>”或“=”,).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com