
下列实验设计能够成功的是
| 实验目的 | 实验步骤及现象 | |
| A | 检验亚硫酸钠试样是否变质 |
|
| B | 检验某盐是否为铵盐 |
|
| C | 证明酸性条件H2O2氧化性比I2强 |
|
| D | 除去氯化钠晶体中少量硝酸钾 |
|
科目:高中化学 来源: 题型:
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
A.②中由水电离出的c(H+)=1×10-12 mol/L
B.将①、③混合,若有pH=7,则消耗溶液的体积:③>①
C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L
D.将四份溶液均稀释10倍后溶液pH:③>④,②<①
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关
系如图所示( 图中的△H表示生成1mol产物的数据)。根据图示,回答下列问题:
⑴P和Cl2反应生成PCl3(g)的热化学方程式 ▲ 。
⑵PCl5(g)分解成PCl3(g)和Cl2的热化学方程式 ▲ 。
⑶白磷能自燃,红磷不能自燃。白磷转变成红磷为 ▲ (“放”或“吸”) 热反应。如果用白磷替代红磷和Cl2反应生成1molPCl5的△H3,则△H3 ▲ △H1 (填“<”、“>” 或 “=”) 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、—3 | —2 |
下列叙述正确的是
A.X、Y元素的最高价氧化物对应的水化物的碱性 :Y比X弱
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于浓氨水
D.一定条件下,X单质可以将W单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法错误的是
A.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
B.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
C.硬铝属于合金材料,瓷器属于硅酸盐制品
D.食醋可去除水垢,NH4Cl溶液可去除铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
苯是重要的化工原料,请回答以下制备中的有关问题:
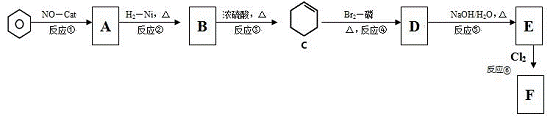
已知:I.CH3CH=CH2 + Cl2  ClCH2CH=CH2 + HCl
ClCH2CH=CH2 + HCl
Ⅱ. F的结构简式为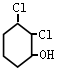
(1)指出反应类型。反应①是氧化反应,反应③是 。
(2)写出结构简式:B ;D 。
(3)C生成D时还可能生成另一种有机物,分离D和该有机物的方法是
。
(4)检验A是否全部转化为B可用的试剂是 。
(5)写出F与NaOH水溶液共热的反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定因素是反应物本身性质的是( )
A.Cu能与浓硝酸反应,而不能与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温常压下不能反应,放电时可反应
D.Cu与浓硫酸能反应,而与稀硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C.浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com