
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: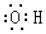 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
分析 A.乙烯的结构简式中漏掉了碳碳双键;
B.氢氧根离子带有1个单位负电荷,电子式中需要标出所带电荷;
C.钙离子的核电荷数为20,最外层达到8电子稳定结构;
D.分子式中只表示出原子种类和数目即可.
解答 解:A.乙烯分子中含有1个碳碳双键,结构简式中必须标出官能团结构,乙烯正确的结构简式为:CH2=CH2,故A错误;
B.氢氧根离子为阴离子,电子式中必须标出最外层电子及所带电荷,其正确的电子式为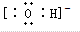 ,故B错误;
,故B错误;
C.Ca2+的核外电子总数为18,最外层满足8电子稳定结构,其离子结构示意图为: ,故C正确;
,故C正确;
D.CH3CH2Br为结构简式,溴乙烷正确的分子式为:C2H5Br,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、结构简式、分子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 | |
| B. | 1 mol Na2O2与CO2和水蒸气的混合气体完全反应,转移1 mol电子 | |
| C. | 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3 | |
| D. | a g CO和CH4的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
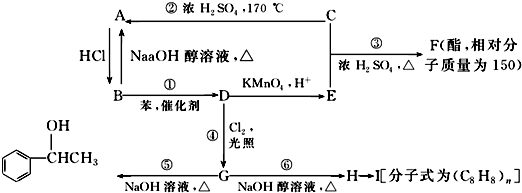
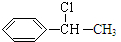
 ;I
;I .
. ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$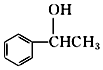 +NaCl;
+NaCl; 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
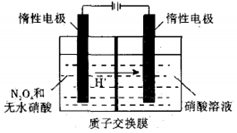 N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.
N2O5是绿色硝化试剂,溶于水可得硝酸.图是以N2O4为原料电解制备N2O5的装置示意图写出阳极区生成N2O5的电极反应式是N2O4-2e-+2HNO3=2N2O5+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com