
| A. | 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 | |
| B. | 1 mol Na2O2与CO2和水蒸气的混合气体完全反应,转移1 mol电子 | |
| C. | 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3 | |
| D. | a g CO和CH4的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
分析 A、过氧化钠具有强氧化性,可与水反应生成氢氧化钠;
B、若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则每摩尔Na2O2完全反应时转移电子1mol;
C、Na2O2与等物质的量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,根据二者的物质的量的关系来判断残留固体;
D、利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
解答 解:A、过氧化钠具有强氧化性,可与水反应生成氢氧化钠,则将足量Na2O2投入紫色石蕊试液中,溶液先变蓝后褪色,同时有气泡产生,故A错误;
B、若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则每摩尔Na2O2完全反应时转移电子1mol,故B正确;
C、NaHCO3与Na2O2混合,在密闭容器中充分加热,碳酸氢钠固体加热反应方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,所产生的气体CO2和H2O与Na2O2的反应为2CO2+2Na2O2=2Na2CO3+O2↑,2H2O+2Na2O2=4NaOH+O2↑,则剩余固体为Na2CO3和NaOH,故C错误;
D、2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量,所以CH4反应后固体增重大于CH4的质量,则固体质量增加大于a g,故D错误;
故选:B.
点评 本题考查混合物的计算,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,是解答该题的关键.


科目:高中化学 来源: 题型:实验题
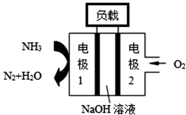 (1)已知
(1)已知查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与稀盐酸反应 O2-+2H+═H2O | |
| B. | 向碳酸氢钠溶液中滴加稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向澄清石灰水中通入少量CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3 | |
| B. | 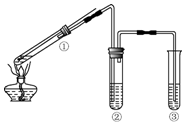 用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色 | |
| C. | 取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1 | |
| D. | 电解熔融氯化铝制备金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
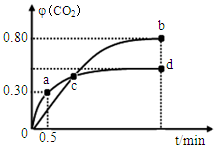 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
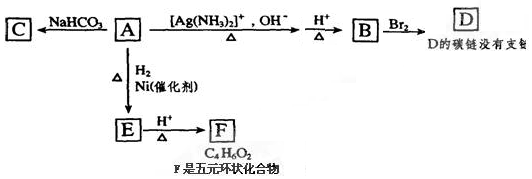
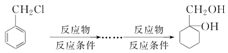
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (写结构简式).
(写结构简式).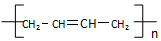 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 氢氧根的电子式: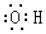 | ||
| C. | Ca2+的结构示意图为  | D. | 溴乙烷的分子式:CH3CH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com