
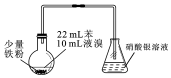
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 烧瓶中反应发生后,有白雾产生,继而充满红棕色气体 | |
| C. | 实验加入试剂的顺序可以是:苯、液溴、铁粉 | |
| D. | 为了增强验证HBr的实验效果,可将锥形瓶中的导管插入溶液中 |
分析 由制备装置可知,苯与液溴在催化剂作用下发生取代反应生成溴苯和HBr,HBr极易结合水蒸气形成酸雾,且HBr极易溶于水,以此来解答.
解答 解:A.生成溴苯时,苯环上H被Br取代,为取代反应,故A正确;
B.生成HBr极易结合水蒸气形成酸雾,反应为放热反应,液溴挥发,继而充满红棕色气体,故B正确;
C.铁粉为催化剂,反应为放热反应,苯与溴易挥发,且溴与铁反应,实验加入试剂的顺序可以是:苯、液溴、铁粉,故C正确;
D.HBr极易溶于水,不能将锥形瓶中的导管插入溶液中,易发生倒吸,故D错误;
故选D.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意选项C为解答的难点,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=10-13mol•L-1的溶液中:Na+、AlO2-、S2-、SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+ | |
| D. | 常温下,由水电离出的c(H+)•c(OH-)=1.0×10-26的溶液中:K+、Na+、HCO3-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CH3COONa固体 | B. | 通入少量HCl气体 | ||
| C. | 升高温度 | D. | 加入少量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与C形成的化合物溶于水所得溶液显碱性 | |
| B. | B与D形成的化合物溶于水所得溶液显酸性 | |
| C. | 氢化物的稳定性:C>D | |
| D. | 简单离子的半径:B>C>D>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极应与X相连接 | |
| B. | H十透过质子交换膜由右向左移动 | |
| C. | 当N电极消耗0.25mol气体时,则铁电极增重16g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
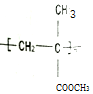 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与Ag+浓度有关 | B. | Ag2+也是该反应的催化剂 | ||
| C. | Ag+能降低该反应的活化能和焓变 | D. | v(Cr3+)=v(S2O82-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
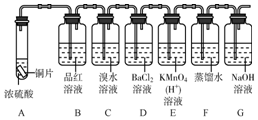 下面是某同学学习硫元素的学习方案.
下面是某同学学习硫元素的学习方案.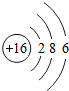 ,从结构知道硫元素是一种典型非金属元素.
,从结构知道硫元素是一种典型非金属元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com