
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,一定条件下可以发生如下转化(水参与的反应,水未标出)。
![]()
(1)符合上述转化关系的A、X、B、C为____________________(填字母代号)
a.NaOHCO2Na2CO3NaHCO3 b.NaO2Na2ONa2O2
c.NH3 O2 NO NO2 d.FeCl2 FeCl2 FeCl3
(2)X为无色无味能使澄清石灰水变浑浊的气体,则C为_________________(填化学式)。若B中混有少量C杂质,除杂的化学方程式为_________________。
(3)C为红棕色气体,则A是_______或________(填化学式),若A的水溶液显碱性,写出A→B的化学方程式______________________________,B和C可相互转化,写出C→B的化学方程式_____________________________。
(4)若C为淡黄色固体,则B为___________,写出C在潜水艇中作为供氧剂牵涉的两个反应方程式__________、________。
(5)除(1)涉及的转化外,再写出一组符合转换关系的A、X、B、C ____ (填化学式)。
【答案】abc NaHCO3 2NaHCO3![]() Na2CO3+H2O+CO2↑ NH3 N2 4NH3+O2
Na2CO3+H2O+CO2↑ NH3 N2 4NH3+O2 4NO+4H2O 3NO2+H2O=2HNO3+NO Na2O 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ S(H2S)、O2、SO2、SO3
4NO+4H2O 3NO2+H2O=2HNO3+NO Na2O 2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ S(H2S)、O2、SO2、SO3
【解析】
氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,二氧化碳能与碳酸钠溶液反应生成碳酸氢钠,符合上述转化关系;
常温下,钠与氧气反应生成氧化钠,加热条件下,氧化钠与氧气反应能生成过氧化钠,符合上述转化关系;
氨气在催化剂作用下,与氧气加热反应生成一氧化氮和水(或氮气在放电条件下,与氧气反应生成一氧化氮),一氧化氮与氧气反应生成二氧化氮,符合上述转化关系;
硫在氧气中燃烧生成二氧化硫(或硫化氢在氧气中燃烧生成二氧化硫和水),二氧化硫在催化剂作用下,二氧化硫与氧气共热反应生成三氧化硫。
(1)a.氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,二氧化碳能与碳酸钠溶液反应生成碳酸氢钠,符合上述转化关系,故正确;
b.常温下,钠与氧气反应生成氧化钠,加热条件下,氧化钠与氧气反应能生成过氧化钠,符合上述转化关系,故正确;
c.氨气在催化剂作用下,与氧气加热反应生成一氧化氮和水,一氧化氮与氧气反应生成二氧化氮,符合上述转化关系,故正确;
d.铁在氯气中燃烧只能生成氯化铁,不能生成氯化亚铁,不符合上述转化关系,故错误;
abc正确,故答案为:abc;
(2)若X为无色无味能使澄清石灰水变浑浊的气体,则X为二氧化碳、A为氢氧化钠、B为碳酸钠、C为碳酸氢钠;若碳酸钠中混有碳酸氢钠,可以用加热的方法除去碳酸氢钠,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:NaHCO3;2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:NaHCO3;2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(3)若C为红棕色气体,则X为氧气、A为氨气或氮气、B为一氧化氮、C为二氧化氮,若A的水溶液显碱性,A为氨气,氨气在催化剂作用下,与氧气加热反应生成一氧化氮和水,反应的化学方程式为4NH3+O2 4NO+4H2O;二氧化氮与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:NH3;N2;4NH3+O2
4NO+4H2O;二氧化氮与水反应生成硝酸和一氧化氮,反应的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:NH3;N2;4NH3+O2 4NO+4H2O;3NO2+H2O=2HNO3+NO;
4NO+4H2O;3NO2+H2O=2HNO3+NO;
(4)若C为淡黄色固体,则X为氧气、A为钠、B为氧化钠、C为过氧化钠,在潜水艇中,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,与水反应生成氢氧化钠和氧气,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑;
(5)除(1)涉及的转化外,还可能存在与硫元素有关的物质间的转化,转化关系为硫在氧气中燃烧生成二氧化硫(或硫化氢在氧气中燃烧生成二氧化硫和水),二氧化硫在催化剂作用下,二氧化硫与氧气共热反应生成三氧化硫,则A为硫或硫化氢、X为氧气、B为二氧化硫、C为三氧化硫,故答案为:S(H2S)、O2、SO2、SO3。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ,Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
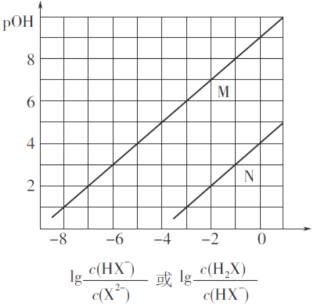
下列叙述正确的是
A. 曲线N表示pOH与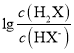 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述不正确的是( )

A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究铜和铁与浓硫酸的反应,实验如下:
① | ② |
| |
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
下列说法正确的是
A. 常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B. ②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C. 依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D. ①②中现象的差异仅是由于温度改变了化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
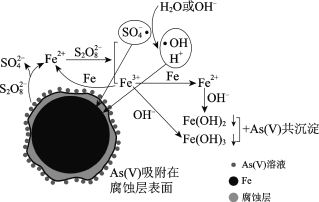
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
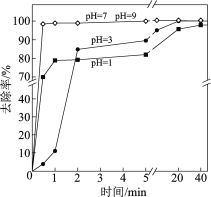
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态硼核外电子占据的最高能级的电子云轮廓图形状为____。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为____。
(3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用____,该晶体的化学式为_____。
(4)铜与(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____,HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是_______。
(5)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
(6)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
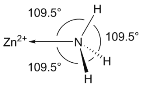
(7)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为________g/cm3。(用含a,NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
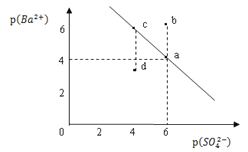
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com