
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是__________________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+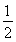 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。

A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+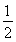 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
(1)①吸热 ②相同 一个化学反应的反应热仅与反应始态和终态有关,而与反应的途径无关 ③CH3OH(g) HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1 (2)C
HCHO(g)+H2(g) ΔH=+(E2-E1)kJ·mol-1 (2)C
【解析】 (1)①E1<E2,甲醇催化脱氢转化为甲醛的反应是吸热反应。②反应热与反应的始态和终态有关,与反应的途径无关,故反应热相同。
(2)采用反应①将CH3OH转变成H2时,反应吸热,采用反应②将CH3OH转变成H2时,反应放热,A错误;反应物的总能量小于生成物的总能量时,反应吸热,B错误;液态甲醇转变成气态甲醇时,要吸收热量,液态甲醇参与反应时,放出的热量比气态甲醇的少,ΔH变大,C正确;反应②放热,1 mol CH3OH(g)和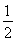 mol O2(g)的总能量大于1 mol CO2(g)和2 mol H2(g)的总能量,与图示不符,D错误。
mol O2(g)的总能量大于1 mol CO2(g)和2 mol H2(g)的总能量,与图示不符,D错误。


科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:

(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。

(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:

下列说法正确的是( )。
A.酸溶时,MnO2作还原剂
B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用
D.在电解池的阴极处产生MnO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )。
4NO(g)+6H2O(g),下列叙述正确的是( )。
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:选择题
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+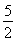 O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+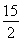 O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是( )。
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:填空题
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为______、______、______。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有________、________。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是________。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为__________________________。
此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为:SO2+2Fe3++2H2O=SO42—+2Fe2++W ①
Cr2O72—+aFe2++bH+―→Cr3++Fe3++H2O ②。
下列有关说法正确的是( )。
A.还原性:Cr3+>SO2
B.方程式②中,a=6,b=7
C.Cr2O72—能将Na2SO3氧化成Na2SO4
D.方程式①中W为OH-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
碳酸钠—过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水里,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15 ℃左右反应1 h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤、干燥得产品。
(1)第1步中,稳定剂与水反应生成两种常见的难溶物,其化学方程式为___________________________________________________________。
(2)第2步中,反应保持为15 ℃左右可采取的措施是_____________________
___________________________________________________。
(3)第3步中,无水乙醇的作用是____________________________________。
(4)H2O2的含量可衡量产品的优劣。现称取m g(约0.5 g)样品,用新煮沸过的蒸馏水配制成250 mL溶液,取25.0 mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250 mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒________、________;
②滴定终点观察到的现象是______________________________________。
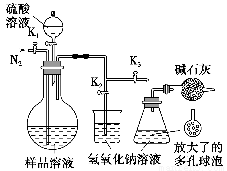
(5)可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50 mL于烧瓶中。
步骤3:准确量取40.00 mL约0.2 mol·L-1 NaOH溶液两份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经分液漏斗向烧瓶中加入10 mL 3 mol·L-1硫酸溶液。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤1~7重复两次。
①步骤3中,准确移取40.00 mL NaOH溶液所需要使用的仪器是________;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是________(填序号);
③为获得样品中碳酸钠的含量,还需补充的实验是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com