
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始=
CO(g)+3H2(g),设起始= Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是

A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中 =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:选择题
下图是某学校实验室从市场买回的试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸和氨水的物质的量浓度分别约为18.4mol•L-1和6.3mol•L-1
B.各取5mL与等质量的水混合后,c(H2SO4)<9.2mol•L-1,c(NH3)>6.45mol•L-1
C.各取5mL与等体积的水混合后,ω(H2SO4)<49%,ω(NH3)>12.5%
D.各取10mL于两烧杯中,再分别加入一定量的水即可得到较稀的硫酸溶液和氨水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二下期末化学试卷(解析版) 题型:选择题
下列电子排布中,原子处于激发状态的是
A. 1s22s22p5
B. 1s22s22p43s2
C. 1s22s22p63s23p63d54s1
D. 1s22s22p63s23p63d34s2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南株洲二中等六校高二下期末化学试卷(解析版) 题型:选择题
设NA为阿伏加罗常数的数值,下列说法正确的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.5.6g铁粉与足量水蒸汽反应生成的H2分子数目为0.1NA
C.向0.1mol/L的FeBr2溶液中通适量Cl2,当c(Br-)=0.1mol/L时,消耗Cl2的分子数为0.1NA
D.在反应Cu2S+O2 2Cu+SO2中,每生成1molCu,转移电子数目为2NA
2Cu+SO2中,每生成1molCu,转移电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末模拟化学试卷(解析版) 题型:实验题
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程。
请你参与并协助他们完成相关学习任务.
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
①称取2.520g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4.
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00mL.
(1)滴定时,将酸性KMnO4标准液装在如图中的_______(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是________________;
(3)通过上述数据,求得x=______;
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会______(填“偏大”、“偏小”或“不变”,下同);
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二下期末模拟化学试卷(解析版) 题型:选择题
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是
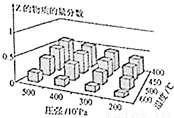
A.在恒温恒容条件下,向已达到平衡的体系中加入少量Z,平衡正向移动,Z的含量增大
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H<0 m+n>c
D.△H>0 m+n<c
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北保定一中高二下期末化学试卷(解析版) 题型:填空题
FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的aL氯化氢气体溶于100g水中,得到的盐酸的密度为bg•mL-1,则该盐酸的物质的量的浓度是______________________________;
(2)向100mL的FeBr2溶液中通入标准状况下Cl23.36L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为______________________________;
(3)FeCl3溶液可以用来净水,其净水的原理为________________________(用离子方程式表示),若用100mL2mol•L-1的FeCl3溶液净水时,生成具有净水作用的微粒数__________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北保定一中高二下期末化学试卷(解析版) 题型:选择题
某同学用下列装置制备并检验Cl2的性质,下列说法中正确的是( )
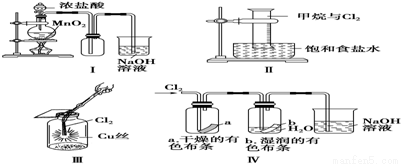
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:简答题
二甲醚(DME)被誉为“21世纪的清 洁燃料”。由合成气制备二甲醚的主要原理如下:
洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有 。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的有____。
CH3OCH3(g)+CO2(g)达到平衡状态的有____。
A.H2和CO2的浓度之比为3:1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)  2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
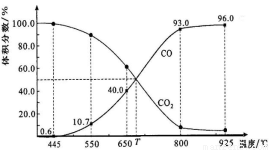
已知:气体分压(P分)=气体总压(P总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550℃时,平衡后若充入惰性气体,平衡_______(填“正移”、“逆移”或“不 移动”)
移动”)
②650℃时,反应达平衡后CO2的转化率为__________________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数KP=_________P总。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com