
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气 后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
【答案】
(1)48
(2)m(Na2CO3·10H2O) = 572g
(3)①2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ △m = 48g
△m = 48g
NO + NO2 + Na2CO3 → 2NaN O2 + CO2↑ △m = 32g
O2 + CO2↑ △m = 32g
设由NO2与纯碱反应产生的CO2为a mol
由NO和NO2与纯碱反应产生的CO2为b mol
或
n(NaNO2):n(NaNO3) = 5:3
②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol
据Na+守恒:5x + 3x = 4 x = 0.5
m(NaNO2) = 172.5g,m(H2O)余 = 1000×78.8% - 688 = 100g
析出:m(NaNO2)(最大)=172.5 – 71.2 = 101.3g
【解析】本题综合考查有关化学方程式、物质的量及溶解度的计算等知识,检查学生的综合应用能力。
(1)2NO2+Na2CO3====NaNO2+NaNO3+CO2↑ Δm
106 g 69g 85g 22.4 L 48 g
22.4 L m
m=48 g
(2)根据Na2CO3质量守恒有:100 g×21.2%=m(Na2CO3·10H2O)·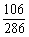
m(Na2CO3·10H2O)=572 g
(3)①2NO2+Na2CO3====NaNO2+NaNO3+CO2↑ Δm=48 g
②NO+NO2+Na2CO3====2NaNO2+CO2↑ Δm=32 g
设由NO2与纯碱反应产生的CO2为a mol,由NO和NO2与纯碱反应产生的CO2为b mol
由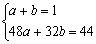 得
得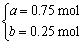
或
a=0.75 mol b=0.25 mol
n(NaNO2)∶n(NaNO3)=5∶3
②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol
据Na+守恒:5x+3x=4 x=0.5
m(NaNO2)=172.5 g,m(H2O)=1 000 g×78.8%-688 g=100 g
析出:m(最大)(NaNO2)=172.5 g-71.2 g=101.3 g


科目:高中化学 来源: 题型:
题6表是食用碘盐包装上的部分说明,下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
题6表
| 配料 | 精盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15 mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX′型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl==HBrO+HCl
KBr+BrCl==KCl+Br2
①写出KI与IBr反应的化学方程式__________________________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式___________________。
⑵下图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
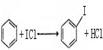
⑶试推测ICl的沸点所处的最小范围______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是
A.臭氧和氧化是氧的同素异形体
B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害
D.臭氧是很好的消毒剂和脱色剂
查看答案和解析>>
科目:高中化学 来源: 题型:
较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200mL 12mol/L 盐酸与17.4g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气。分析实验结果发现:
甲、 乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。
试回答下列问题:
⑴ 上述实验中理论上最多可制得Ca(ClO)2多少克?
⑵ 实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中一定能大量共存的离子组是( )
A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO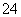 、K+
、K+
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO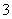 、Cl-
、Cl-
C.常温下,c(H+)=10-14mol/L的溶液中:Na+、AlO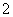 、S2-、SO
、S2-、SO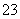
D.常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO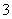 、Ca2+
、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
主链上有四个碳原子的某种烷烃有两种同分异构体,与它含有相同碳原子数且主链也有四个碳原子的单烯烃的同分异构体有( )
A. 2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A.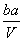 mol·L-1 B.
mol·L-1 B.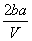 mol·L-1C.
mol·L-1C. 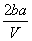 mol·L-1 D.
mol·L-1 D.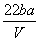 mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com