
较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200mL 12mol/L 盐酸与17.4g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气。分析实验结果发现:
甲、 乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。
试回答下列问题:
⑴ 上述实验中理论上最多可制得Ca(ClO)2多少克?
⑵ 实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
【答案】(1)14.3 g
(2)见解析
【解析】(1)根据题意
n(HCl)=12 mol·L-1×0.2 L=2.4 mol
n(MnO2)= =0.2 mol
=0.2 mol
MnO2+4HCl(浓)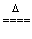 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
n(HCl)∶n(MnO2)=2.4 mol∶0.2 mol=12∶1>4∶1
所以浓HCl过量,应根据MnO2计算。
根据制备氯气的化学方程式n(Cl2)=n(MnO2)=0.2 mol
又因为:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
n〔Ca(ClO)2〕= n(Cl2)=
n(Cl2)= ×0.2 mol=0.1 mol
×0.2 mol=0.1 mol
m〔Ca(ClO)2〕=143 g·mol-1×0.1 mol=14.3 g
(2)①随着反应进行,温度升高,会产生副产物Ca(ClO3)2
6Cl2+6Ca(OH)2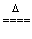 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
②Cl2未与石灰乳完全反应,残余Cl2被NaOH溶液吸收
Cl2+2NaOH====NaCl+NaClO+H2O


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
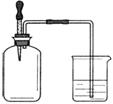
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
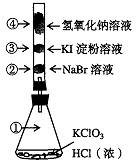
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是_________________________。
装置C中的烧瓶需要加热,其目的是_____________________________________。
②反应一段时间后,装置D中观察到的现象是______________________________________,装置D不能采用普通玻璃管的原因是____________________________________,装置D中发生反应的化学方程式为__________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是( )
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是H2S===2H++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气 后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5 mol/L,下面四个选项中能达到此目的的是( )
A.Fe2+、Na+、NO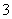 、Cl- B. Mg2+、NH
、Cl- B. Mg2+、NH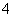 、SO
、SO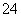 、NO
、NO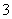
C.H+、K+、Cl-、CH3COO- D.Fe3+、K+、AlO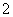 、SO
、SO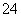
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入KSCN溶液和盐酸,溶液变红色 | 原溶液一定含Fe3+ |
| B | 向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的无色无味气体 | 原溶液一定含CO32- |
| C | 向某溶液中加入稀盐酸无现象,再滴加BaCl2有白色沉淀 | 原溶液一定含SO42- |
| D | 向某溶液滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液一定不含NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据研究需要,可从多个角度对物质进行分类,以下对物质分类的说法中,不正确的是 ( )
A.能与碱反应仅生成盐和水的氧化物称为酸性氧化物
B.在水溶液中能够电离出H+的化合物都称为酸
C.电离时生成的阴离子全部是OH-的化合物称为碱
D.在水溶液中或熔融状态下能够导电的化合物称为电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com