
根据研究需要,可从多个角度对物质进行分类,以下对物质分类的说法中,不正确的是 ( )
A.能与碱反应仅生成盐和水的氧化物称为酸性氧化物
B.在水溶液中能够电离出H+的化合物都称为酸
C.电离时生成的阴离子全部是OH-的化合物称为碱
D.在水溶液中或熔融状态下能够导电的化合物称为电解质
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200mL 12mol/L 盐酸与17.4g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气。分析实验结果发现:
甲、 乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值
甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。
试回答下列问题:
⑴ 上述实验中理论上最多可制得Ca(ClO)2多少克?
⑵ 实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀溶液中含有等物质的量的ZnSO4, Fe2(SO4)3, H2 SO4, CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为( )
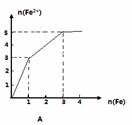
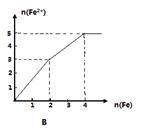

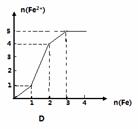
查看答案和解析>>
科目:高中化学 来源: 题型:
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | NH3极易溶于水 | 充满N |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | 常温下,铁与浓硝酸发生钝化 | 常温下,铁与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组在实验室用铜和硫酸为原料,采用多种方法制取硫酸铜,制备方法如下:
方法一:
(1)浓硫酸试剂瓶上适合贴上的标签是________(填序号)。

(2)甲同学取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:____________________________________________________。
实验结论:所得灰白色固体的化学式为________。
(3)乙还观察到加热过程中,试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是(用化学方程式回答)________________________________________________________________________。
直到最后反应完毕,发现试管中还有铜片剩余,乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是_____________________________________________。
方法二:
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2 2CuO,CuO+H2SO4===CuSO4+H2O。
2CuO,CuO+H2SO4===CuSO4+H2O。
对比甲的方案,你认为丙同学的优点是①__________________________________;
②____________________________________________________________________。
方法三:
(5)丁同学取一铜片和稀硫酸放在试管中,再 向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式__________________________________________________。
向其中滴入双氧水发现溶液逐渐呈蓝色,写出反应的化学方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A.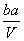 mol·L-1 B.
mol·L-1 B.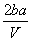 mol·L-1C.
mol·L-1C. 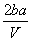 mol·L-1 D.
mol·L-1 D.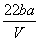 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是
A.原溶液中的Br-一定被氧化B.通入氯气之后原溶液中的Fe2+不一定被氧化
C.不能确定通入氯气之后的溶液中是否存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:4NH3(g)+5O2(g) = 4NO(g)+6H2O(g),若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O) [单位均为mol·L-1·S-1]
A.4/5 v(NH3)= v(O2) B.5/6 v(O2)= v(H2O)
C.2/3 v(NH3)= v(H2O) D.4/5 v(O2)= v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程 式为 ▲ 。
式为 ▲ 。
 (2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24L。(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24L。(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)
①理论上,电解后溶液中c(OH—)= ▲ mol/L。
②若实际测得反应后溶液的c(OH—)=0.1mol/L,则造成这种误差的原因可能是:
a.2H2O 2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是 ▲ g。
2H2↑+O2↑;若仅考虑该原因,则电解过程中溶液减小的质量是 ▲ g。
b.还可能为 ▲ (用离子方程式表示)。
③经测定,该实验中溶液实际减少的质量为4.23g,则所产生的气体及其物质的量之比为
▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com