(2012?江苏三模)草酸合铁酸钾晶体K
x[Fe(C
2O
4)
y]?3H
2O可用于摄影和蓝色印刷.实验室制备草酸合铁酸钾晶体的实验流程如下:
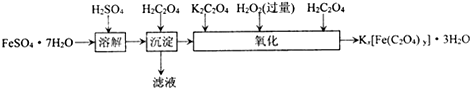
(1)若用铁和稀硫酸制备FeSO?7H
2O,常保持
铁
铁
过量,理由是
防止亚铁离子被氧气氧化
防止亚铁离子被氧气氧化
.
(2)上述流程中,“沉淀”一步所得Fe(C
2O
4)?2H
2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
.
(3)测定草酸合铁酸钾产品中Fe
3+含量和C
2O
含量的实验步骤如下:

步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L
-1HCl 10mol,加热至70~80℃,趁热用SnCl
2-TiCl
3联合还原法将Fe
3+全部还原为Fe
2+,加入MnSO
4溶液10mL,在75~80℃下用0.01000mol?L
-1 KMnO
4标准溶液滴定至终点(Cl
- 不参与反应),将C
2O
全部氧化成CO
2,Fe
2+全部氧化成Fe
3+记录体积.
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
ad
ad
(填序号).
②步骤2中MnSO
4溶液的作用是
作催化剂
作催化剂
,滴定终点的现象是
溶液变为浅红色,且半分钟内部褪色
溶液变为浅红色,且半分钟内部褪色
.
③在不增加试剂种类的前提下,步骤3的目的是
测定C2O42-的含量
测定C2O42-的含量
.





 小题狂做系列答案
小题狂做系列答案