
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】向含amolNaClO的溶液通入bmolSO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是( )
A.当0<b<![]() 时:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
时:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
B.当b=a时:溶液的酸性明显增强
C.![]() ≤b≤a时:反应后溶液中H+的物质的量:0<n(H+)≤2bmol
≤b≤a时:反应后溶液中H+的物质的量:0<n(H+)≤2bmol
D.当0<b<![]() :SO2+H2O+2ClO-=SO32-+2HClO
:SO2+H2O+2ClO-=SO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为![]() ,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
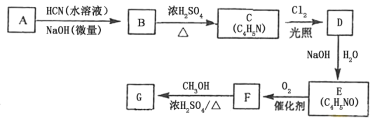
已知:①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰。
②![]()
回答下列问题:
(1)A的化学名称为________________。
(2)B的结构简式为_____________,其核磁共振氢谱显示为_______组峰,峰面积比为_________。
(3)由C生成D的反应类型为__________。
(4)由D生成E的化学方程式为_________________________________________。
(5)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有____种。(不含立体异构)
(6)F与H2反应后生成C4H9NO2,此物质一定条件下发生聚合反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。
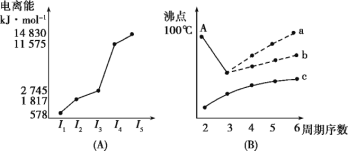
图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年一月一场突如其来的新冠肺炎席卷全球,该病最明显的症状就是出现发热,市售体温枪能快速的检测人体体温,该体温枪所用的电池具有使用寿命长、容量大等特点,应用十分广泛。该种电池由氧化银作为正极,金属锌粉作为负极,电解液为氢氧化钾或氢氧化钠,电池的总反应方程式为Zn + Ag2O + H2O = Zn(OH)2 + 2Ag,根据信息回答下列问题:
(1)该电池在测体温时,将 ________能转化为_________能。
(2)放电时,负极电极反应:_________________;正极电极反应:___________________。
(3)整个过程电解质溶液的pH值__________(填“增大”“减小”或“不变”)。
(4)试计算在放电过程中转移3NA个电子时,正极________(填“增大”或“减小”)的质量的为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有2H2+O2![]() 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
(2)如把H2改为甲烷、H2SO4作导电物质,则电极反应式为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是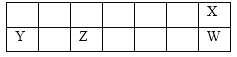
A. 工业上电解YW饱和溶液冶炼金属Y
B. 气态氢化物的稳定性:W > X
C. 简单离子半径的大小顺序:r(Y+)>r(X—)
D. Y、W的最高价氧化物的水化物均能溶解金属Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置a、b、c中分别盛有试剂1、2、3,用如图所示的装置进行实验(夹持仪器略去,必要时可加热),能达到相应实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓 | Cu片 | KI-淀粉溶液 | 验证 |
|
B | 盐酸 | 石灰石 | 饱和 | 制备 | |
C | 稀硫酸 | 溶液X | 澄清石灰水 | 验证溶液X中是否有 | |
D | 70%硫酸 |
| 酸性 | 证明 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com