
【题目】(1)今有2H2+O2![]() 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
(2)如把H2改为甲烷、H2SO4作导电物质,则电极反应式为:________、________。
【答案】H2 O2 2H2+4OH--4e-==4H2O O2+2H2O+4e-==4OH- CH4+2H2O-8e-==CO2+8H+ 2O2+8H++8e-===4H2O
【解析】
试题(1)负极失电子发生氧化反应,正极得电子发生还原反应;(2)负极是甲烷失电子发生氧化反应;正极是氧气得电子发生还原反应;
解析:(1)2H2+O2![]() 2H2O反应中,氢气发生氧化反应、氧气发生还原反应,原电池中负极失电子发生氧化反应,正极得电子发生还原反应,所以负极通的应是H2,负极反应式是2H2+4OH--4e-==4H2O,正极通的应是O2,正极反应式是O2+2H2O+4e-==4OH-;
2H2O反应中,氢气发生氧化反应、氧气发生还原反应,原电池中负极失电子发生氧化反应,正极得电子发生还原反应,所以负极通的应是H2,负极反应式是2H2+4OH--4e-==4H2O,正极通的应是O2,正极反应式是O2+2H2O+4e-==4OH-;
(2)负极是甲烷失电子发生氧化反应,负极反应式是CH4+2H2O-8e-==CO2+8H+;正极是氧气得电子发生还原反应,正极反应式是2O2+8H++8e-===4H2O。


科目:高中化学 来源: 题型:
【题目】回答一下回答以下关于第三周期元素及其化合物的问题。
(1)Na原子核外共有___种不同运动状态的电子,Al的原子结构示意图___。
(2)相同压强下,部分元素氟化物的熔点见表:

试解释上表中氟化物熔点差异的原因:___。
(3)SiF4分子的空间构型为____,SiF4中Si-F键间的键角是____。
(4)在P、S、Cl三种元素形成的氢化物中,热稳定性最大的是____(填氢化物的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
A. v(A2)=0.008 mol·L-1·s-1B. v(A2)=0.3 mol·L-1·min-1
C. v(AB3)=0.01 mol·L-1·s-1D. v(B2)=0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
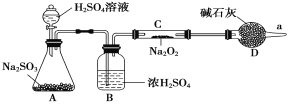
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
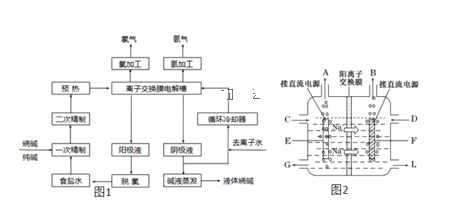
(1)该流程中可以循环的物质是____。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式___。
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是___,E电极的名称是___。电解总反应的离子方程式为____。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列装置或操作描述正确的是( )
A.  用于实验室制乙烯
用于实验室制乙烯
B. 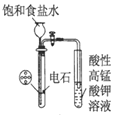 用于实验室制乙炔并检验乙炔
用于实验室制乙炔并检验乙炔
C.  用于实验室中分馏石油
用于实验室中分馏石油
D.  中A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚
中A为醋酸,B为碳酸钙,C为苯酚钠溶液,则可验证酸性:醋酸>碳酸>苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com