
【题目】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如图1所示:
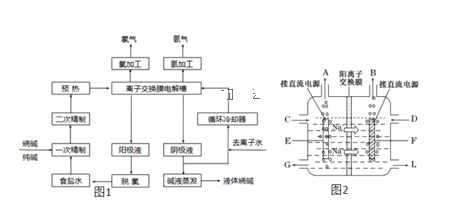
(1)该流程中可以循环的物质是____。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式___。
(3)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是___,E电极的名称是___。电解总反应的离子方程式为____。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为___。
【答案】氯化钠、氢氧化钠 Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓ H2 阳极 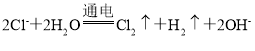 Na2SO3+Cl2+H2O=Na2SO4+2HCl 93.46%
Na2SO3+Cl2+H2O=Na2SO4+2HCl 93.46%
【解析】
(1)根据工艺流程图结合电解工艺的原料以及产物知识来判断;
(2)除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液写出离子方程式;
(3)电解池中,阳离子移向阴极,根据钠离子移动方向确定阴阳极,根据电解池的工作原理来书写方程式;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(5)计算生成NaOH的质量,根据理论耗电量和实际耗电量计算。
(1)根据工艺流程图结中用到的原料以及产物,可以知道氯化钠、氢氧化钠是可以循环使用的;
答案:氯化钠、氢氧化钠;
(2)除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液,离子方程式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓;
(3)电解池中,阳离子钠离子移向阴极,所以B是电源的负极,A是正极,E是阳极,在阴极上产生的是氢气,电解饱和食盐水的原理方程式为: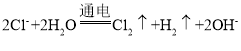 ,B处产生氢气;
,B处产生氢气;
(4)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,即Na2SO3+Cl2+H2O=Na2SO4+2HCl;
(5)烧碱溶液质量为1.342×103kg/m3×113m3=1.516×105kg,m(NaOH)=1.516×105kg×32%=4.85×104kg,则理论上需要电流量为![]() =3.252×107,则实际上耗电量为1.45×104×8×300=3.48×107,该电解槽的电解效率为
=3.252×107,则实际上耗电量为1.45×104×8×300=3.48×107,该电解槽的电解效率为![]() ×100%=93.46%。
×100%=93.46%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】完成下列问题
(1)硬脂酸甘油酯的结构简式____________
(2)用系统命名法命名 ![]() 为___________________
为___________________
(3)酸催化条件下制备酚醛树脂的化学方程式____________________________________________
(4)1,3-丁二烯与丙烯等物质的量发生加聚反应的化学方程式______________________________
(5)葡萄糖发生银镜反应的化学方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今有2H2+O2![]() 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
(2)如把H2改为甲烷、H2SO4作导电物质,则电极反应式为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 稀醋酸中加入少量醋酸钠固体能降低醋酸的电离程度
B. 25 ℃时,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C. CaCO3的水溶液导电性很弱,但CaCO3是强电解质
D. 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0 ℃~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:
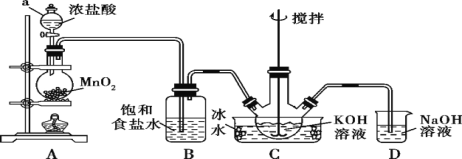
回答下列问题:
(1)制备KClO。
①仪器a的名称是________________;装置B吸收的气体是________。
②装置C中三颈烧瓶置于冰水浴中的目的是______________;装置D的作用是_____________。
(2)制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为________________________________。
②向装置C中加入饱和________溶液,析出紫黑色晶体,过滤。
(3)测定K2FeO4纯度。测定K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
a.FeO42-+CrO2-+2H2O═CrO42-+Fe(OH)3↓+OH-
b.2CrO42-+2H+═Cr2O72-+H2O
c.Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
称取2.0g制备的K2FeO4样品溶于适量KOH溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250mL容量瓶中定容.取25.00mL加入稀硫酸酸化,用0.10 molL-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00mL,则该K2FeO4样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)800℃时,某密闭容器中存在如下反应:2NO2(g) ![]() 2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
2NO(g) + O2(g) △H>0,若开始向容器中加入1mol/L的NO2,反应过程中NO的浓度随时间的变化如图曲线I所示
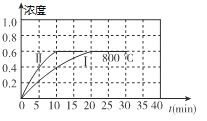
①反应Ⅱ相对于反应I而言,改变的条件可能是_______________.
②800℃时,若开始时向容器中同时加入1mol/LNO、0.2mol/LO2、0.5mol/L NO2,则v正____________v逆(填“<”、“>”或“=”)
(2)己知N2O4(g) ![]() 2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t min时,将一定量的NO2、N2O4,充入一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
c(Y)(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
①c(X)代表__________(填化学式)的浓度,该反应的平衡常数K=_____________。
②前10min内用NO2浓度变化表示的反应速率为___________,20min时改变的条件是_____________;重新达到平衡时,NO2的质量分数___________________。
a.增大 b.减小
c.不变 d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 煤的干馏和石油裂解得到的产物相同
C. 石油分馏得到的产物可用来萃取溴水中的溴
D. 聚丙烯塑料的结构简式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com