
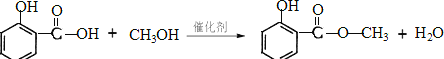
【题目】水杨酸甲酯是一种无色透明油状液体,相对分子质量为152,密度为1.184gcm﹣3,沸点223.3℃,熔点﹣86℃,微溶于水,易溶于有机溶剂,露置在空气中则易缓慢变色。由水杨酸和甲醇在浓硫酸存在条件下反应制得水杨酸甲酯(冬青油)的反应如下:

某学校的实验探究小组利用如图装置制备冬青油.步骤如下

①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为4.56g
试回答下列问题:
(1)装置中仪器a的作用是_______________;水应该从________(填“Ⅰ”或“Ⅱ”)处流入,仪器b的适宜规格为___________(填序号);
①10℃ ②50℃ ③150℃
(2)加入NaHCO3溶液的目的除了将冬青油中的甲醇、水杨酸、硫酸等除去外,还有___________;加入水震荡分层后,冬青油的粗产品在_______(填“上”或“下”)层;
(3)在本实验分离过程中,水层应该从分液漏斗的_________________(填“上口倒出”或“下口放出”);
(4)本次实验冬青油的产率是____________。
【答案】冷凝回流 Ⅱ ③ 降低冬青油在水中的溶解度 下层 上口倒出 60%
【解析】
(1)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计;
(2)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g/cm-3,比水溶液重;
(3)冬青油的粗产品的密度比水大,水层应从分液漏斗的上口倒出;
(4)结合反应定量关系计算理论量,产率=![]() ×100%。
×100%。
(1)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好,应从Ⅱ通入;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计,选择150℃的温度计;
故答案为:冷凝管,Ⅱ;③;
(2)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g/cm-3,比水溶液重,粗产品在下层;
故答案为:降低冬青油在水中的溶解度;下层;
(3)冬青油的粗产品的密度比水大,水层应从分液漏斗的上口倒出;
故答案为:上口倒出;
(4)结合反应定量关系计算理论量,
138 152
6.9g m
m=7.6g
产率=![]() ×100%=
×100%=![]() ×100%=60%。
×100%=60%。


科目:高中化学 来源: 题型:
【题目】钴是国民经济建设和国防建设不可缺少的重要原料之一,从锂离子二次电池正极![]() 废料--铝钴膜中回收钴的工艺如图所示:
废料--铝钴膜中回收钴的工艺如图所示:

回答下列问题:
(1)写出工业上用![]() 制取铝的化学方程式______
制取铝的化学方程式______
(2)工艺图中加入氢氧化钠净化的目的是______
(3)为使钴浸出。需将![]() 的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式______
(4)锂可由电解制得,以石墨为阳极,低碳钢为阴极,电解液为熔融的LiCl和KCl的混合液,电解槽压为6.0-6.5V,这样可得到纯度为99%的锂。
①在电解液中加人KCl的原因______
②阴极产物与镁的性质相似,在常温下与氮气反应,请写出其与氮气反应的生成物与水的反应方程式______
③已知阴极产物在500℃与氢气能反应生成氢化物,请写出该氢化物的电子式______
(5)已知钴与铁的性质相似,请写出四氧化三钴与氢碘酸反应的离子方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中![]() 的含量,其工作原理如图所示,
的含量,其工作原理如图所示,![]() 被氧气化为
被氧气化为![]() ,下列说法错误的是
,下列说法错误的是

A. 溶液中![]() 向电极b移动
向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的![]() 与
与![]() 的物质的量之比为4:5
的物质的量之比为4:5
D. 正极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.已知:![]()
![]() ,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于
,则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于![]() kJ
kJ
B.![]() 、30MPa下,将
、30MPa下,将![]() mol
mol![]() 和
和![]() mol
mol![]() 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成![]() 放热
放热![]()
![]() 其热化学方程式为:
其热化学方程式为:![]()
![]()
C.![]()
![]() ,则
,则![]()
D.在101kPa时,2g![]() 完全燃烧生成液态水,放出
完全燃烧生成液态水,放出![]() kJ热量,氢气燃烧的热化学方程式表示为
kJ热量,氢气燃烧的热化学方程式表示为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com