
【题目】电化学气敏传感器可用于监测环境中![]() 的含量,其工作原理如图所示,
的含量,其工作原理如图所示,![]() 被氧气化为
被氧气化为![]() ,下列说法错误的是
,下列说法错误的是

A. 溶液中![]() 向电极b移动
向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的![]() 与
与![]() 的物质的量之比为4:5
的物质的量之比为4:5
D. 正极的电极反应式为:![]()
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
①B能使湿润的红色石蕊试纸变蓝,A、C、D不能使湿润的石蕊试纸变色,E、G均可使湿润的蓝色石蕊试纸变红;
②F呈红棕色;
③G和H均能使品红褪色,A在H中安静燃烧并产生苍白色火焰;
④C在D中完全燃烧生成E和H2O,同时放出大量热,工业上可利用该反应焊接或切割金属。
请回答下列问题:
(1)E的电子式为_____,D中所含元素的基态原子核外电子排布式为___,C分子中的σ键和π键的个数之比为___。
(2)写出实验室用固体药品制取B的化学方程式_______________。
(3)若从a口通入气体G,从b口通入气体F,X为氯化钡溶液,观察到的现象是_____________,
反应的离子方程式为_________________。

(4)已知:E(g)+3A(g)![]() CH3OH(l)+H2O(l) ΔH=-53.66 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-53.66 kJ·mol-1
2CH3OH(l)![]() CH3OCH3(g)+H2O(l) ΔH=-23.4 kJ·mol-1
CH3OCH3(g)+H2O(l) ΔH=-23.4 kJ·mol-1
写出E有催化剂时与A合成二甲醚(CH3OCH3)的热化学方程式_____________。
(5)气体C能使硫酸酸化的高锰酸钾溶液褪色,产物之一是E,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C5H7Cl的有机物,其结构不可能是( )
A.只含1个![]() 键的直链有机物
键的直链有机物
B.含2个![]() 键的直链有机物
键的直链有机物
C.含1个![]() 键的环状有机物
键的环状有机物
D.含1个—C![]() C—键的直链有机物
C—键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不能用勒夏特列原理解释的是
A.可用浓氨水和氢氧化钠固体快速制取氨气
B.锌与稀硫酸反应,加入少量硫酸铜反应速率加快
C.光照新制的氯水时,溶液的pH逐渐减小
D.增大压强,有利于![]() 和
和![]() 反应生成
反应生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
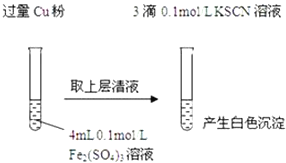
(1)Fe3+与Cu粉发生反应的离子方程式为______.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸甲酯是一种无色透明油状液体,相对分子质量为152,密度为1.184gcm﹣3,沸点223.3℃,熔点﹣86℃,微溶于水,易溶于有机溶剂,露置在空气中则易缓慢变色。由水杨酸和甲醇在浓硫酸存在条件下反应制得水杨酸甲酯(冬青油)的反应如下:

某学校的实验探究小组利用如图装置制备冬青油.步骤如下

①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为4.56g
试回答下列问题:
(1)装置中仪器a的作用是_______________;水应该从________(填“Ⅰ”或“Ⅱ”)处流入,仪器b的适宜规格为___________(填序号);
①10℃ ②50℃ ③150℃
(2)加入NaHCO3溶液的目的除了将冬青油中的甲醇、水杨酸、硫酸等除去外,还有___________;加入水震荡分层后,冬青油的粗产品在_______(填“上”或“下”)层;
(3)在本实验分离过程中,水层应该从分液漏斗的_________________(填“上口倒出”或“下口放出”);
(4)本次实验冬青油的产率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种金属组成的合金10g投入足量的稀硫酸中,反应完全后得到氢气11.2L(标准状况下),此合金可能是 ( )
A.镁铝合金B.镁铁合金C.铝铁合金D.镁锌合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com