
【题目】化学式为C5H7Cl的有机物,其结构不可能是( )
A.只含1个![]() 键的直链有机物
键的直链有机物
B.含2个![]() 键的直链有机物
键的直链有机物
C.含1个![]() 键的环状有机物
键的环状有机物
D.含1个—C![]() C—键的直链有机物
C—键的直链有机物
科目:高中化学 来源: 题型:
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:![]()

已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是___________,冷凝管中冷水应从______(填“a”或“b”) 处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是_________(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________________;_________________;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________________;
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则lt苯可制得成品为________________t(只要求列式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
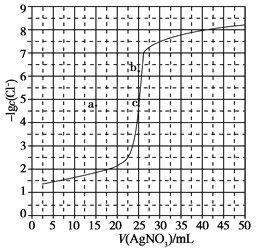
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
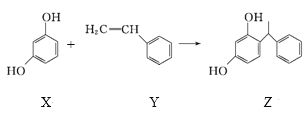
下列叙述错误的是( )
A.X、Y和Z均能使溴水褪色
B.X和Z均能与NaHCO3溶液反应放出CO2
C.Y既能发生取代反应,也能发生加成反应
D.Y可作加聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛化合物常见价态有+2和+4。钛白粉(TiO2,两性氧化物)用途广泛。工业上由高钛渣(主要成分为Ti3O5,还含有TiO2、Fe2O3等)制取钛白粉的主要工艺过程如下:
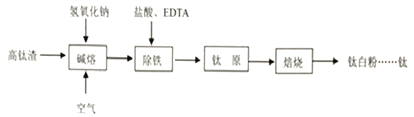
(1)写出碱熔步骤所发生反应的化学方程式____________、____________。
(2)实验测定EDTA加入量(EDTA和Fe3+的物质的量之比)对 Ti4+和Fe3+溶出率的影响如图所示。由图可知,EDTA的加入量为____________时除铁效率最佳,理由是____________。

(3)在实验室模拟除铁净化后的实验步骤:①向钛原料中加入稀硫酸生成偏钛酸(H2TiO3)沉淀,反应结束后过滤;②洗涤;③……;④在650℃下高温焙烧得到较纯的钛白粉固体。步骤③的实验目的是____________,需要用到的试剂有____________。
(4)测定钛白粉纯度:称取试样0.200g在CO2气氛下用金属铝将钛(IV)还原成钛(Ⅲ),还原后的溶液以NH4SCN为指示剂,用0.08mol/L的 NH4Fe(SO4)2标准液滴定,滴定终点时消耗标准液29.20mL,钛白粉的纯度为____________。(保留三位有效数字)
(5)最新研究发现也可以用图示装置由TiO2获得金属钛。装置中阳极的电极反应方程式为____________,在制备金属钛前后,整套装置中CaO的总量____________(填写“增大”、“减小”或者“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.打开可乐瓶有大量泡沫冒出
B.新制的氯水在光照下颜色变浅
C.用饱和食盐水除去氯气中氯化氢杂质
D.容器中有H2(g)+I2(g)![]() 2HI(g),增大压强颜色变深
2HI(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
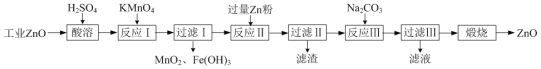
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com