
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
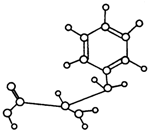
| A. | 能与NaOH发生反应,但不能与盐酸反应 | |
| B. | 能发生缩聚反应 | |
| C. | 能发生加成反应 | |
| D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 加热时,②、③中的溶液为无色,冷却后又都变红 | |
| C. | ④中,浸泡在热水中的容器内气体颜色变浅,浸泡在冰水中的容器内气体颜色变深 | |
| D. | 四个“封管实验”中不是都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| B. | Al2O3熔点高,可用作耐高温材料 | |
| C. | 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板 | |
| D. | NaHCO3溶于水呈碱性,可作抗酸药,服用时喝些醋能提高药效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| C. | 常温下,4 g CH4含有2 NA个C-H共价键 | |
| D. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| D. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$ K↑+NaCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度NaHSO4和Ba(OH)2两溶液等体积混合H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 在含有Mn2+的溶液中加入稀硝酸酸化,再加入PbO2反应体系显紫红色5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Na2O2投入H218O中:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com