
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
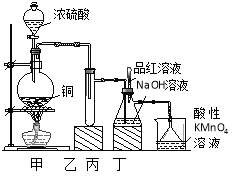
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
步骤3: | 若 则 ; 否则 。 |
【答案】(17分)
(1)(2分)防止丙中液体倒吸入装置甲中(或缓冲瓶的作用)
(2)(3分) 5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+
(3)3分)还原性(1分) SO2+Cl2+2H2O=H2SO4+2HCl(2分)
(4)(2分)品红溶液褪色
(5)(7分)
实验操作 | 预期现象与结论 |
步骤2:再滴入过量2mol/L盐酸(1分),振荡(1分) | 产物中存在Na2SO3(1分) |
步骤3:用试管取适量滤液A(1分),向其中 加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸。),振荡(1分) | 若出现浑浊(或红色褪去),则产物中存在NaHSO3(1分);否则不存在NaHSO3(1分)。 |
评分说明:
(1)文字中只要写出加有着重号的文字、化学式或类似的意思,该评分点给分;
(2)用品红检验SO32-或HSO3-时:①如果先加盐酸、后加品红,SO2量少且挥发一部分,可能会出现品红不褪色而误判,这种情况两处合起来扣1分;②如果不加品红、只滴盐酸,两处合起来扣1分。
【解析】
试题分析:(1)读图可知,装置甲中Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,SO2不仅易溶于水,而且易溶于装置丙中的NaOH溶液,因此丙中溶液易倒吸进入甲装置内的浓硫酸中,易造成安全事故,所以装置乙的作用就是防止丙中液体倒吸入装置甲中(或起缓冲瓶或安全瓶的作用);(2)丁装置中KMnO4作强氧化剂,SO2作还原剂,锰元素由+7价降为+2价,硫元素由+4价升为+6价,根据化合价升降总数相等、原子个数守恒可知,2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,或者5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+;(3)氯水是强氧化剂,可以将SO2氧化为SO42-,即SO2+Cl2+2H2O=H2SO4+2HCl,则SO2是还原剂,显还原性;(4)若SO2不足,丙中反应为SO2+2NaOH=Na2SO3+H2O;若SO2过量,丙中先发生的反应为SO2+2NaOH=Na2SO3+H2O,后发生的反应为Na2SO3+H2O+SO2=2NaHSO3,由此推断丙中SO2过量,则滴入品红溶液会褪色,因为二氧化硫具有漂白性;(5)Na2SO3与BaCl2易反应生成BaSO3沉淀,而NaHSO3与BaCl2不能反应;BaSO3易溶于盐酸,并放出能使品红溶液褪色的SO2气体,因此步骤2中先向洗涤后的固体滴入2滴或少量品红溶液,再滴入过量2mol/L盐酸,振荡,若固体完全溶解,品红褪色或有气泡,则装置丙的产物中含有Na2SO3;由于可溶性的NaHSO3易与Ba(OH)2反应生成BaSO3沉淀,或者NaHSO3易与盐酸反应放出能使品红溶液褪色的SO2气体,故步骤3中可用试管取适量滤液A,向其中加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸),振荡,若出现浑浊(或红色褪去),则装置丙的产物中存在NaHSO3;否则不存在NaHSO3。
CuSO4+SO2↑+2H2O,SO2不仅易溶于水,而且易溶于装置丙中的NaOH溶液,因此丙中溶液易倒吸进入甲装置内的浓硫酸中,易造成安全事故,所以装置乙的作用就是防止丙中液体倒吸入装置甲中(或起缓冲瓶或安全瓶的作用);(2)丁装置中KMnO4作强氧化剂,SO2作还原剂,锰元素由+7价降为+2价,硫元素由+4价升为+6价,根据化合价升降总数相等、原子个数守恒可知,2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,或者5SO2+2MnO4-+2H2O =5SO42-+2Mn2++4H+;(3)氯水是强氧化剂,可以将SO2氧化为SO42-,即SO2+Cl2+2H2O=H2SO4+2HCl,则SO2是还原剂,显还原性;(4)若SO2不足,丙中反应为SO2+2NaOH=Na2SO3+H2O;若SO2过量,丙中先发生的反应为SO2+2NaOH=Na2SO3+H2O,后发生的反应为Na2SO3+H2O+SO2=2NaHSO3,由此推断丙中SO2过量,则滴入品红溶液会褪色,因为二氧化硫具有漂白性;(5)Na2SO3与BaCl2易反应生成BaSO3沉淀,而NaHSO3与BaCl2不能反应;BaSO3易溶于盐酸,并放出能使品红溶液褪色的SO2气体,因此步骤2中先向洗涤后的固体滴入2滴或少量品红溶液,再滴入过量2mol/L盐酸,振荡,若固体完全溶解,品红褪色或有气泡,则装置丙的产物中含有Na2SO3;由于可溶性的NaHSO3易与Ba(OH)2反应生成BaSO3沉淀,或者NaHSO3易与盐酸反应放出能使品红溶液褪色的SO2气体,故步骤3中可用试管取适量滤液A,向其中加入过量lmol/L氢氧化钡溶液(或滴入2滴品红,再滴入过量2mol/L盐酸),振荡,若出现浑浊(或红色褪去),则装置丙的产物中存在NaHSO3;否则不存在NaHSO3。


科目:高中化学 来源: 题型:
【题目】由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z)。X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是

A. 工业上常用电解乙制备X
B. 甲、乙、丙均能与水发生化合反应
C. X为第二周期IIA族元素,Y和Z位于同一主族
D. X可用于制焰火烟花,Z可用作太阳能电池的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。铬渣综合利用工艺流程如下:

请回答下列问题:
(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应方程式为_____ 。
(2)除去浸出液中的杂质最好加入_____(填试剂名称)来调节pH。除去铝元素的离子方程式为______________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是___________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料.遇到空气中的硫化物颜色会变然,该过积的化学反应方程式为_____________。
(5)实验室常利用Cr3+在碱性溶液中的还原性,使其转化为CrO42-,从而实现与Al3+的分离,这个过程中需要加入的试剂是__________(填化学式),分离操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
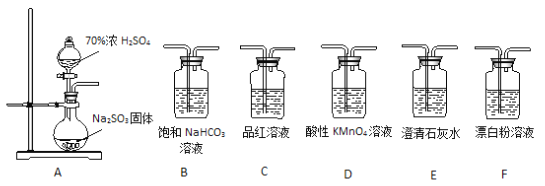
(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
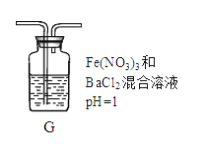
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当光束通过下列分散系:①有尘埃的空气 ②鸡蛋清 ③冰水混合物 ④氢氧化铁胶体,能观察到丁达尔效应的是
A. ①②④ B. ①②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H6Br2的有机物,其结构不可能是( )
A.只含有一个双键的直链有机物
B.含两个双键的直链有机物
C.含一个双键的环状有机物
D.含一个三键的直链有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述不正确的是
A. 贝诺酯分子中有2种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. lmol乙酰水杨酸最多消耗3molNaOH
D. 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氮基酚钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com