
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
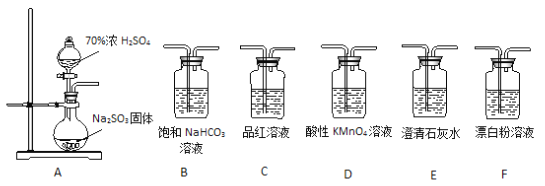
(1)装置A中反应的化学方程式为________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________→_________→C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________。
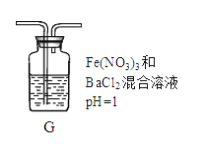
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________,样品中Na2SO3质量分数是_____________。
【答案】 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O B D 检验SO2是否除尽 C中品红溶液不褪色,E中石灰水变浑浊 BaSO4 SO2和Fe3+、酸性条件下NO3-都反应 取少量反应后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,说明反应后有Fe2+生成。(也可用其他方法证明反应后溶液中有Fe2+,合理即可) 由无色变为紫红色 84%
【解析】试题分析:(1)装置A中亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫、水;
(2)二氧化硫能被漂白粉氧化,不能把二氧化硫直接通入漂白粉溶液中证明亚硫酸酸性强于次氯酸,先用二氧化硫通入饱和碳酸氢钠中制备二氧化碳,再用二氧化碳与漂白粉反应从而证明亚硫酸>碳酸>次氯酸;(2)证亚硫酸与碳酸的酸性强弱,需要把二氧化硫通入饱和碳酸氢钠溶液中制备二氧化碳,通入高锰酸钾溶液中除去二氧化碳中的二氧化硫,再通入品红溶液中验证二氧化硫是否除尽,最后通入澄清石灰水中,若石灰水变浑浊,则亚硫酸酸性大于碳酸的酸性;(4)二氧化硫被硝酸氧化为硫酸根离子,最后生成硫酸钡沉淀;二氧化硫可能被NO3―、Fe3+共同氧化; Fe3+被还原的产物是Fe2+,取少量反应后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,说明反应后有Fe2+生成;(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是溶液由无色变为紫红色,根据![]() 计算样品中Na2SO3质量分数。
计算样品中Na2SO3质量分数。
解析:(1)装置A中亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫、水,反应方程式是Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O;
(2)根据以上分析,证明亚硫酸酸性强于次氯酸,先用二氧化硫通入饱和碳酸氢钠中制备二氧化碳,再用二氧化碳与漂白粉反应从而证明亚硫酸>碳酸>次氯酸,连接顺序是SO2→碳酸氢钠溶液→高锰酸钾溶液→品红溶液→漂白粉溶液;A→(B)→(D) →C→F;
(2)证亚硫酸与碳酸的酸性强弱,需要把二氧化硫通入饱和碳酸氢钠溶液中制备二氧化碳,通入高锰酸钾溶液中除去二氧化碳中的二氧化硫,再通入品红溶液中验证二氧化硫是否除尽,最后通入澄清石灰水中,若C中品红溶液不褪色,E中石灰水变浑浊,则亚硫酸酸性大于碳酸的酸性;
(4)二氧化硫被硝酸氧化为硫酸根离子,最后生成硫酸钡沉淀;根据题意,可能SO2和Fe3+、酸性条件下NO3-都反应; Fe3+被还原的产物是Fe2+,取少量反应后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,说明反应后有Fe2+生成,证明SO2被Fe3+氧化;
(5)达到滴定终点时锥形瓶中溶液由无色变为紫红色,
设15.0 g Na2SO3样品中含Na2SO3 x mol,根据

![]()
x=0.1mol,
15.0 g Na2SO3样品中含Na2SO3的质量0.1×126g/mol=12.6g,样品中Na2SO3质量分数是![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置如下:

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/ g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。

将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝酸基苯18 g。回答下列问题:
(1)装置B的名称是___________,装置C的作用是____________________。
(2)配制混合液时,________(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:____________________________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是____________。
(4)在洗涤操作中,第二次水洗的作用是_____________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140 ℃,应选用空气冷凝管,不选用直形冷凝管的原因是________________________________。
(6)本实验所得到的硝基苯产率是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比为___________。
(2)2.5 mol Ba(OH)2中含有__________个OH-,2.5 mol Ba(OH)2的质量是___________g。
(3)在标准状况下,1.7 g氨气所占的体积约为___________L,它与标准状况_________L硫化氢含有相同数目的氢原子。
(4)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为_____________。
(5)同温同压下,SO2与氦气的密度之比为___________,若质量相同,两种气体的体积比为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. w=17c/(1 000ρ)
C. w=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
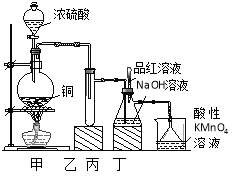
(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 | 若品红褪色(或有气泡),则 |
步骤3: | 若 则 ; 否则 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人认为在元素周期表中位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是
A. NaH B. H3O+ C. HF D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生成锂离子电池。下列说法正确的是
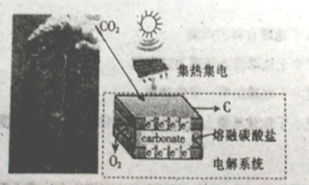
A. 图中能量转化方式只有一种
B. 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑
C. 若反应中转移1mole-,则理论上消耗CO32-0.5mol
D. 当生成12g碳材料时,可收集到22.4LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com