
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )
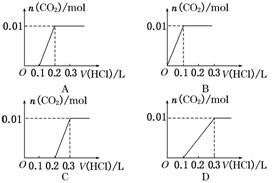
C
解析:本题考查NaOH、Na2CO3的性质,意在考查考生对无机反应原理的分析和图象数据的处理能力.向NaOH和Na2CO3混合溶液中滴加盐酸,发生反应:OH-+H+===H2O、CO +H+===HCO
+H+===HCO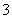 、HCO
、HCO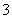 +H+===H2O+CO2↑,则开始产生CO2时消耗的n(HCl)=n(NaOH)+n(Na2CO3)=
+H+===H2O+CO2↑,则开始产生CO2时消耗的n(HCl)=n(NaOH)+n(Na2CO3)=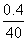 +
+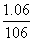 =0.02(mol),V(HCl)=
=0.02(mol),V(HCl)=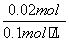 =0.2 L,产生CO2的最大物质的量为n(CO2)=n(Na2CO3)=
=0.2 L,产生CO2的最大物质的量为n(CO2)=n(Na2CO3)=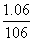 =0.01(mol),当NaOH、Na2CO3完全反应时,继续滴加盐酸不再产生CO2,总共消耗的n(HCl)=n(NaOH)+2n(Na2CO3)=0.03(mol),V(HCl)=
=0.01(mol),当NaOH、Na2CO3完全反应时,继续滴加盐酸不再产生CO2,总共消耗的n(HCl)=n(NaOH)+2n(Na2CO3)=0.03(mol),V(HCl)=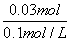 =0.3 L,C项正确.
=0.3 L,C项正确.


科目:高中化学 来源: 题型:
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式______________________________________。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为________个、________个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
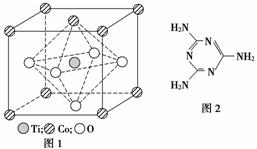
三聚氰胺分子中氮原子轨道杂化类型是________,1 mol三聚氰胺分子中σ键的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种溶液中各含一种X-(X-为Cl-、Br-或I-)离子,向甲溶液中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化,则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构式如图所示: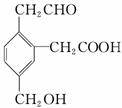 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A.②③④ B.①③⑤⑥
C.①③④⑤ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
尼泊金甲酯是苯的含氧衍生物,在化妆品中可作防腐剂。回答下列问题:
(1)尼泊金甲酯的结构简式为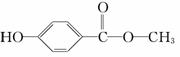 ,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
___________________________________________________________________ _____。
_____。
(2)尼泊金甲酯的一种同分异构体A,满足以下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种。写出A的可能的结构简式:____________________。
(3)尼泊金甲酯的另一种同分异构体B,其苯环上的取代基彼此相间,有如下转化关系:
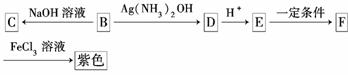
已知C的化学式为C8H7O3Na,F的化学式为C8H6O3。
填写下列空白:
①B中的官能团名称是________________,E→F的反应类型为________;
②F的结构简式为____________________;
③写出E与乙醇反应的化学方程式(有机物写结构简式,并注明反应条件):________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是________(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
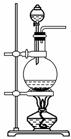 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是____________。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0.100 0 mol·L-1NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为____________mol·L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果________(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
 ④进行丁方案实验:装置如图所示(夹持器具已略去)。
④进行丁方案实验:装置如图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到________中。
(ii)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是________(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
阿斯巴甜具有清爽的甜味,甜味度约为蔗糖的200倍。有关说法不正确的是( )
A.阿斯巴甜的分子式为C14H17N2O5
B.水解产物中有两种氨基酸
C.阿斯巴甜属于蛋白质
D.阿斯巴甜一定条件下既能与酸反应,又能与碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com