
| ����ʽ/�ṹʽ | NO/N��O | CO/C��O | CO2/O=C=O | N2/N��N |
| ��ѧ�� | N��O | C��O | C=O | N��N |
| ���ܣ�KJ/mol�� | 632 | 1072 | 750 | 946 |
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO��/��10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n��CO��/��10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
���� ��1���ٻ�ѧ��Ӧ���ʱ���ڷ�Ӧ��ɼ��������յ������Ͳ������¼������ͷŵ�����֮��ݴ˻ش���㣻
�ڸ��ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��2������ƽ�ⳣ������������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻�������ƽ��Ũ�ȼ��ɼ����ƽ�ⳣ��������Ӱ�췴Ӧ���ʺ�ƽ���ƶ����������ش�
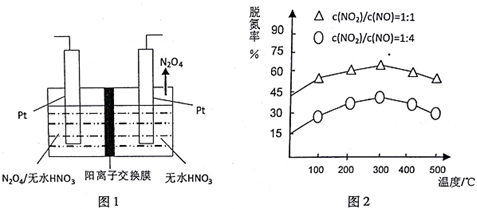
��3��������������N2O4ʧ��������N2O5����ϵ����غ���������
��4������ͼʾ�õ��¶Ⱥ��ѵ��ʵĹ�ϵ300��֮ǰ���¶������ѵ���������300��֮���¶������ѵ�����С���ݴ˽���¶ȶ�ƽ���ƶ���Ӱ��֪ʶ���شɣ�
��� �⣺��1���ٻ�ѧ��Ӧ���ʱ���ڷ�Ӧ��ɼ��������յ������Ͳ������¼������ͷŵ�����֮�����2NO��g��+2CO�� g��?N2�� g��+2CO2��g���ġ�H=��2��632+1072��2��-��750��4+946��kJ/mol=-538kJ/mol���ʴ�Ϊ��-538kJ/mol��
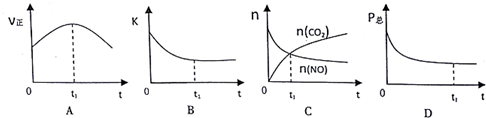
��A��t1ʱ����Ӧ������Ȼ�ڱ仯��˵��û�дﵽƽ��״̬����A����
B��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��Ӧ�ں��¡����ݵ��ܱ���ϵ�н��У�Kʼ�ղ��䣬��B����
C��t1ʱ������̼��һ�����������ʵ������ڱ仯��˵�����淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬����C����
D����Ӧǰ�������ϵ���ͱ仯��������ѹ�����״̬�ﵽ��ƽ��״̬����D��ȷ��
��ѡABC��
��2��NO��CO��Ӧ����CO2��N2����Ӧ����ʽΪ��
2NO+2CO?2CO2 +N2
��ʼŨ�ȣ�1��l0-2 3.6��l0-2 0 0
ת��Ũ�ȣ�0.9��l0-2 0.9��l0-2 0.9��l0-2 0.45��l0-2
ƽ��Ũ�ȣ�0.1��l0-2 2.7��l0-2 0.9��l0-2 0.45��l0-2
��Ӧ��ƽ�ⳣ��K=$\frac{��0.45��1{0}^{-2}����0.9��1{0}^{-2}��^{2}}{��0.1��1{0}^{-2}��^{2}��2.7��1{0}^{-2}��^{2}}$=500����ѹ��������Ӧ��������ʹƽ�������ƶ���
�ʴ�Ϊ��500����ѹ��
��3��Pt��������������N2O4ʧ��������N2O5���缫��ӦʽΪ��N2O4+2HNO3-2e-=2N2O5+2H+���ʴ�Ϊ��N2O4+2HNO3-2e-=2N2O5+2H+��
��4������ͼʾ��Ϣ�õ���300��֮ǰ���¶������ѵ���������300��֮���¶������ѵ�����С��������Ϊ��300��֮ǰ����Ӧδƽ�⣬��Ӧ���ҽ��У��ѵ�������300��ʱ��Ӧ��ƽ�⣬������ƽ�������ƶ����ѵ��ʼ�С��
�ʴ�Ϊ��300��֮ǰ���¶������ѵ���������300��֮���¶������ѵ�����С��300��֮ǰ����Ӧδƽ�⣬��Ӧ���ҽ��У��ѵ�������300��ʱ��Ӧ��ƽ�⣬������ƽ�������ƶ����ѵ��ʼ�С��
���� ���⿼���˸�˹���ɵ�Ӧ�á���ѧƽ��״̬���жϡ�ƽ�ⳣ���ļ����Լ�Ӱ�췴Ӧ���ʵ����ص�֪ʶ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ɫ��Һ��MnO4- Na+ I- Mg2+ | |
| B�� | ����0.1mol/L Fe3+ ����Һ�У�Na+ Ca2+ SCN- SO42- | |
| C�� | ����Ƭ��Ӧ������������Һ��CO32- SO42- Na+ NH4+ | |
| D�� | ʹ��̪��Һ������Һ��Na+ Cl- NO3- Ba2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 һ�ֹ⻯ѧ��صĽṹ��ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��AgCl��s��=AgCl��s��=Ag ��s��+Cl��AgCl����[Cl��AgCl����ʾ���ɵ���ԭ���������Ȼ�������]������Cl��AgCl��+e-��Cl-��aq����������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ���ǣ�������
һ�ֹ⻯ѧ��صĽṹ��ͼ���������ڱ���Ϳ���Ȼ�������Ƭ��ʱ��AgCl��s��=AgCl��s��=Ag ��s��+Cl��AgCl����[Cl��AgCl����ʾ���ɵ���ԭ���������Ȼ�������]������Cl��AgCl��+e-��Cl-��aq����������Դ�Ƴ�����ػ������ظ�����ʼ״̬������˵����ȷ���ǣ�������| A�� | ����ʱ��������Y����X | |
| B�� | ����ʱ��Pt�缫�����ķ�ӦΪ2Cl-+2e-�TCl2 | |
| C�� | ����ʱ��Cl-��Ag�缫�ƶ� | |
| D�� | ����ʱ������ܷ�ӦΪ��AgCl��s��+Cu+��aq��$\frac{\underline{\;��\;}}{\;}$Ag ��s��+Cu2+��aq��+Cl-��aq�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
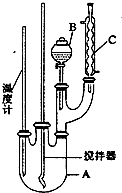 ʵ�����Ʊ��������ķ�Ӧԭ����ʵ��װ�����£�
ʵ�����Ʊ��������ķ�Ӧԭ����ʵ��װ�����£� +HO-NO2$��_{50-60��}^{H_{2}SO_{4}}$
+HO-NO2$��_{50-60��}^{H_{2}SO_{4}}$ NO2+H2O��H��0
NO2+H2O��H��0| ���� | �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | �ܽ��� |
| �� | 5.5 | 80 | 0.88 | ����ˮ |
| ������ | 5.7 | 210.9 | 1.205 | ������ˮ |
| ��������� | 89 | 301 | 1.57 | ����ˮ |
| Ũ���� | 83 | 1.4 | ������ | |
| Ũ���� | 338 | 1.84 | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3.4g H2O2�к��еĹ��õ��Ӷ���Ϊ0.1NA | |
| B�� | ��״���£�11.2 L��CH4��C2H4��ɵĻ�������к�����ԭ�ӵ���ĿΪ2 NA | |
| C�� | ��״���£�2.24L��������ˮ������Ӧ��ת�Ƶĵ�����ĿΪ0.1 NA | |
| D�� | 25�棬pH=13��NaOH��Һ�У�����OH-����ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
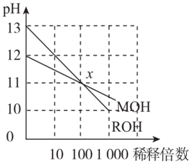
| A�� | ROH��һ��ǿ�MOH��һ������ | |
| B�� | ��Ũ�ȵ�MOH�����ᷴӦ��������Һ�����ԣ���V��MOH����V�����ᣩ | |
| C�� | ��x�㣬c��M+��=c��R+�� | |
| D�� | ϡ��ǰ��c��ROH��=10c��MOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����˿����ѹ���� | B�� | �ò��������ʳ�� | ||
| C�� | �����۳�����Ũ���� | D�� | ��Ӳ�����ƺ������IJ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com