
【题目】下列物质的溶液不需要用棕色试剂瓶保存的是
A. HClO B. NH4Cl C. HNO3 D. AgNO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
A. X2+具有还原性 B. X的+2价化合物比+4价化合物稳定
C. XO2具有强氧化性 D. 该元素是第ⅡA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是___________________________________________
【设计、完成实验】
(1)称取_______g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和___________________________。
②下列操作会使所配溶液浓度偏低的是_______(填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x =________________,假设___________成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定并记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
判断滴定终点的现象为_____________________________。上述实验中KMnO4溶液的物质的量浓度为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。请回答:

(1)写出物质A的化学式:_____________ ;
(2)得到F溶液的操作Ⅰ的名称为:________________;
(3)若I是红褐色沉淀,请写出下列转化的化学方程式:
B→G:_________________;G + F → I:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
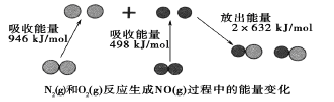
A. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
B. 1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C. 在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min)
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 蒸发NaAlO2溶液可以获得固体NaAlO2 | NaAlO2在水中不会水解 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com