
【题目】可逆反应2A(g) ![]() 2B(g)+C(g)在恒定容积密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是
2B(g)+C(g)在恒定容积密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是
A. 混合气体中A与B的物质的量之比保持恒定
B. 容器内气体总压强不再改变的状态
C. 用A、B、C的物质的量浓度变化表示的反应速率的比为2:2:1
D. 混合气体的平均相对分子质量不再改变的状态
【答案】C
【解析】A. 因A和B分别是反应物和生成物,混合气体中A与B的物质的量之比保持恒定,说明A和B的浓度不再改变,反应达到了平衡状态,故A不选;B. 因2A(g)![]() 2B(g)+C(g)是反应前后气体体积不相等的可逆反应,容器内气体总压强不再改变,说明反应达到了平衡状态,故B不选;C. 因未说明用A、B、C的物质的量浓度变化表示的反应速率是正反应速率还是逆反应速率,无法证明正反应速率等于逆反应速率,则不能说明反应达到了平衡状态,故C选;D. 因反应前后气体的质量不变,但气体的总物质的量改变,所以混合气体的平均相对分子质量改变,当混合气体的平均相对分子质量不再改变时,说明反应达到了平衡状态,故D不选;答案选C。
2B(g)+C(g)是反应前后气体体积不相等的可逆反应,容器内气体总压强不再改变,说明反应达到了平衡状态,故B不选;C. 因未说明用A、B、C的物质的量浓度变化表示的反应速率是正反应速率还是逆反应速率,无法证明正反应速率等于逆反应速率,则不能说明反应达到了平衡状态,故C选;D. 因反应前后气体的质量不变,但气体的总物质的量改变,所以混合气体的平均相对分子质量改变,当混合气体的平均相对分子质量不再改变时,说明反应达到了平衡状态,故D不选;答案选C。


科目:高中化学 来源: 题型:
【题目】醋酸中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,下列措施可以使c(CH3COOH)/c(H+)的值减小 的是
CH3COO-+H+,下列措施可以使c(CH3COOH)/c(H+)的值减小 的是
A. 加入水 B. 加入少量氢氧化钠固体
C. 加入少量冰醋酸 D. 加入少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是
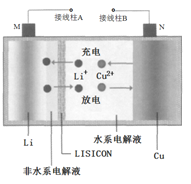
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的负极相连
D. 电池充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7 g铝和4.6 g钠同时加入足量的水中充分反应,将反应后的溶液稀释、定容为500 mL。下列说法中正确的是
A. 所得溶液中阳离子和阴离子的物质的量之比为1∶1
B. 参加反应的水的质量与加入铝的质量相等
C. 所得溶液中钠离子和铝离子物质的量之比为2∶1
D. 反应中放出的气体在标准状况下的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是将传统的燃料与空气直接接触反应的燃烧借助于载氧剂(如Fe2O3、FeO等)的作用分解为几个气固反应,燃料与空气无需接触,由载气剂将空气中的氧传递给燃料。回答下列问题:
(1)用Fe2O3作载氧剂的化学链燃烧部分热化学方科式及循环转化的原理如下:
I.C(s)+H2O(g)==CO(g)+H2(g) △H1
II.Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) △H2
III.Fe2O3(s)+1/3H2(g)=2/3Fe3O4(s)+1/3H2O(g) △H3
IV.Fe3O4(s)+1/4O2(s)=3/2Fe2O3 (s) △H4
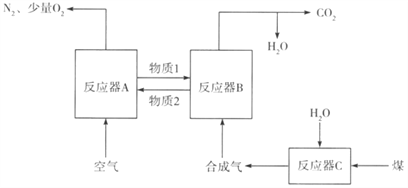
①在反应器B中进行的反应是_______(填反应前面的代号);“物质2”是______(填化学式)。
②反应C(s)+O2(g)=CO2(g)的△H=______(用△H1、△H2、△H3、△H4表示)。
(2)用FeO作载氧剂部分反应的lgKp[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]与温度的关系如下图所示:
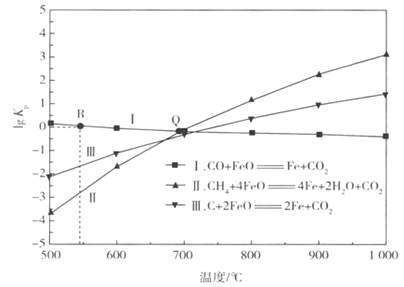
①图中涉及的反应中,属于吸热反应的是______(填反应前面的代号)。
②恒容密闭容器中进行反应:CH4(g) +4FeO(s)=4Fe(s) +2H2O(g)+CO2(g),不能说明该反应已达到化学平衡的标志是______( 填字母)。
a.v正(CH4)=v正(CO2)
b.气体的压强不再随时间变化
c.气体的密度不再随时间变化
d.单位时间内断裂C-H键与断裂H-O键数目相等
③若某恒容密闭容器中只发生反应I和II,平衡时对应上图中Q 处时,容器中气体分压p(X)间应满足的关系是__________。
④在某密闭容器中充入0.8 molCO和0.2 mol CO2 并加入足量的FeO,只发生反应I,在R点(lgKp=0),则CO的平衡转化率为________。
(3)若用CaSO4作载氧剂进行化学链燃烧时,CaSO4与CO发生反应生成CaS,则反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:

已知:“沉锰”反应为:Mn2+ + 2HCO![]() == MnCO3↓+ H2O + CO2↑
== MnCO3↓+ H2O + CO2↑
(1)“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ == 2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为________。(任写一个)
(2)“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是_________。(答两点)

(3)“过滤Ⅱ”所得滤液中溶质的主要成分是_________。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O![]() + 4H+
+ 4H+ ![]() Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O
Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O![]() + H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
+ H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com