
分析 FeCl3溶液与铜反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向溶液中加入铁粉,若溶液中还剩有三价铁,铁粉先与三价铁反应,再与铜离子反应,从溶液中置换出固体铜,利用此知识解答即可.
解答 解:(1)向100ml 2mol•L-1FeCl3溶液中加入6g铜粉,完全溶解,发生的化学反应:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)完全溶解后,再加入a g铁粉,充分反应后得到b g固体,若铜很少,发生的反应有:Cu+2Fe3+=Cu2++2Fe2+,2Fe3++Fe=3Fe2+,Cu2++Fe═Cu+Fe2+;若铜很多发生的反应有:Cu+2Fe3+=Cu2++2Fe2+,Cu2++Fe═Cu+Fe2+,说明最后得到的固体肯定有铜,当b>6时,溶液中的铜离子全部析出,则最后得到的溶液中一定含有的金属阳离子是亚铁离子,
故答案为:Fe2+;
(3)三价铁物质的量为2mol/L×0.1L=0.2mol,铜的物质的量为$\frac{6g}{64g/mol}$=0.09375mol,则消耗的三价铁为0.09375mol×2=0.1875mol,溶液中余下的三价铁为0.2mol-0.1875mol=0.0125mol,生成的铜离子为0.09375mol,再加入铁粉ag,三价铁氧化性更强,先发生的反应是2Fe3++Fe=3Fe2+,则消耗铁的物质的量为0.0125mol×$\frac{1}{2}$=0.00625mol,再发生反应:Cu2++Fe═Cu+Fe2+,充分反应后得到bg固体,b=6,说明溶液中的铜全部析出,参加反应的铁为0.09375mol,则共消耗铁(0.09375mol+0.00625mol)×56g/mol=5.6g,
故答案为:5.6g.
点评 本题考查了金属活动性顺序的应用,要注意根据铁和铜的活动性强弱确定反应的先后顺序,试题培养了学生的分析能力及化学计算能力,有一定难度.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等 | |
| C. | 若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有AgCl沉淀析出 | B. | 无AgCl沉淀 | ||
| C. | 无法确定 | D. | 有沉淀但不是AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
| A. | 碳酸盐 | B. | 硫酸盐 | C. | 硫化物 | D. | 以上沉淀剂均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯发生的是取代反应 | |
| C. | C5H10不属于烷烃,而C5H12属于烷烃且有3种同分异构体 | |
| D. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物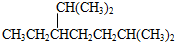 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使高锰酸钾溶液褪色 | |
| D. | 结构片段为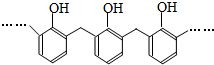 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com