
| A. | H2+Cl2═2HCl | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | D. | H2+CuO$\frac{\underline{\;高温\;}}{\;}$H2O+Cu |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:实验题
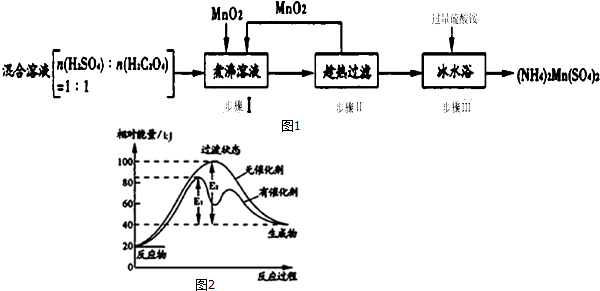
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
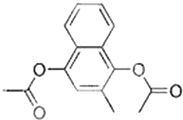 维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )
维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )| A. | ①②③ | B. | ③④⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜检验 | B. | Y有同分异构体 | ||
| C. | M含有两种碳氧共价键 | D. | Y可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HClO都是弱酸,HClO3、HClO4均为强酸 | |
| B. | HBr的水溶液有酸性、氧化性、还原性 | |
| C. | HI的水溶液还原性很强,在空气中易被氧化变质 | |
| D. | HX水溶液酸性顺序为:HCl>HBr>HI>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚俗称石炭酸,酸性比碳酸强 | |
| B. | 皮肤上若沾有少量苯酚,正确的处理方法是用70℃热水洗 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 乙醇熔沸点比含相同碳原子的烷烃熔沸点高的主要原因是乙醇分子之间易形成氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com