
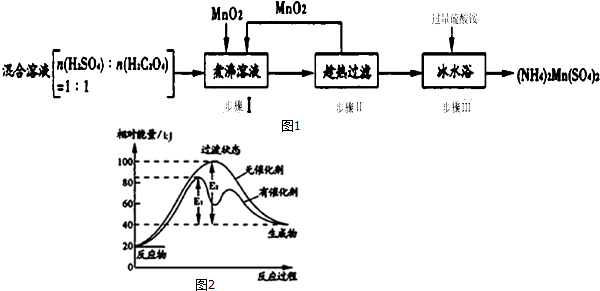
���� ��1���������ǻ��ϼ۽��͵ķ�Ӧ�
��2���¶Ƚ��ͣ���MnSO4������������NH4��2Mn��SO4��2��������渽������������NH4+��SO42-��
��3��A�������ִμ�����������ܹ���߶������̵Ľ����ʣ�
B�����ȹ��˷�ֹ����ʱ���¶Ƚ�����MnSO4����������
C����ˮԡ�����ȴ�ǽ��Ͳ�Ʒ��ˮ���ܽ�ȣ�
D������ˮ����ƾ���Һϴ�ӻ�ʹ��Ʒ����ˮ����ʧ��
��4�����ݷ�Ӧ�ȡ�H=��Ӧ����ܼ���-��������ܼ��ܣ������ı䷴Ӧ���̣��Ȳ��뷴Ӧ�����ɣ����ͻ�ܣ�
��5������п�̵�ص��ܷ�Ӧ�ǣ�Zn+2MnO2+2H2O�T2MnOOH+Zn��OH��2��Zn���������+2�ۣ�ʧȥ����Ϊ�������缫��ӦΪ��Zn-2e-+2OH-=Zn��OH��2�����ܷ�Ӧ��ȥ������Ӧ�����ɵ�������Ӧ���������غ㽨����ϵʽ��MnO2����NH4��2Mn��SO4��2�����
��� �⣺��1���ڲ���I�ķ�Ӧ�У�MnO2���̵Ļ��ϼ���+4�۽�Ϊ+2�ۣ�������������
�ʴ�Ϊ��MnO2��
��2��������г��ȹ���ǰ����MnSO4��Һ�м���������ˮ����Ŀ����ʹ��Һ�¶ȴ��ڸ��»�������ֹ����ʱ���¶Ƚ�����MnSO4����������
������У�NH4��2Mn��SO4��2��������渽������������NH4+��SO42-�����þƾ���Һϴ�ӣ�ϴȥ����Ҫ����������NH4+��SO42-��
�ʴ�Ϊ����ֹ����ʱ���¶Ƚ�����MnSO4����������NH4+��SO42-��
��3��A�������ִμ�����������ܹ���߶������̵Ľ����ʣ���߲�Ʒ���ʣ���A��ȷ��
B�����ȹ��˷�ֹ����ʱ���¶Ƚ�����MnSO4������������߲�Ʒ���ʣ���B��ȷ��
C����ˮԡ�����ȴ�ǽ��Ͳ�Ʒ��ˮ���ܽ�ȣ���߲�Ʒ�����ʣ���C��ȷ��
D����ˮ����ƾ���Һϴ�ӻ�ʹ��Ʒ����ˮ����ʧ�����ʽ��ͣ���D����
��ѡABC��
��4����ͼ���֪��H=40 kJ/mol-20 kJ/mol=+20 kJ/mol�������ı䷴Ӧ���̣��Ȳ��뷴Ӧ�����ɣ����ͻ�ܣ�
�ʴ�Ϊ��+20 kJ/mol���ǣ�
��5������п�̵�ص��ܷ�Ӧ�ǣ�Zn+2MnO2+2H2O�T2MnOOH+Zn��OH��2��Zn���������+2�ۣ�ʧȥ����Ϊ�������缫��ӦΪ��Zn-2e-+2OH-=Zn��OH��2�����ܷ�Ӧ��ȥ������Ӧ�����ɵ�������Ӧ��2MnO2+2H2O+2e-=2MnOOH+2OH-��
MnO2����NH4��2Mn��SO4��2
87 283
87g m
���m=283g
�ʴ�Ϊ��2MnO2+2H2O+2e-=2MnOOH+2OH-��283��
���� ������Ҫ���黯�������в���Ŀ�ġ�ԭ���й����⣬�漰֪ʶ��϶࣬������ѧ������֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
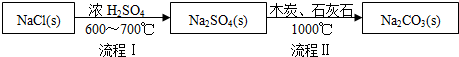
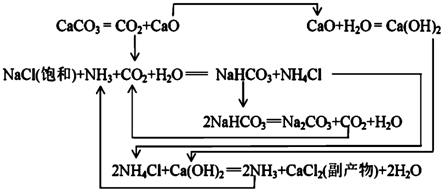
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

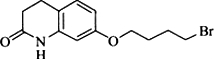 ���京�����������ļ����Ѽ���д���ƣ���
���京�����������ļ����Ѽ���д���ƣ���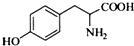 ��
��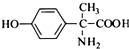
 д����C�Ʊ�������
д����C�Ʊ������� �ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$H2C$\stackrel{Br_{2}}{��}$
�ĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�CH3CH2OH$��_{170��}^{Ũ����}$H2C$\stackrel{Br_{2}}{��}$
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����������ȼ�ϵ�������������ݣ�Westinghouse����˾���ƿ����ģ����Թ��������-������Ϊ����ʣ����ֹ��������ڸ��������������ӣ�O2-�������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ���ǣ�������
����������ȼ�ϵ�������������ݣ�Westinghouse����˾���ƿ����ģ����Թ��������-������Ϊ����ʣ����ֹ��������ڸ��������������ӣ�O2-�������ͨ�����õ�صĹ���ԭ����ͼ��ʾ�����ж�缫a��b��������缫��Ӧ�������ж���ȷ���ǣ�������| A�� | ��O2�μӷ�Ӧ��a��Ϊ��صĸ��� | |
| B�� | ��H2�μӷ�Ӧ��b��Ϊ��ص����� | |
| C�� | a����Ӧ�ĵ缫��ӦʽΪO2+2H2O-4e�T4OH- | |
| D�� | �õ�ص��ܷ�Ӧ����ʽΪ��2H2+O2�T2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
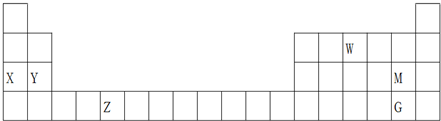
| A�� | ����������ˮ����ļ��ԣ�X��Y | |
| B�� | W���⻯������ģ��Ϊ�� | |
| C�� | ���ԣ�HMO4��HGO4 | |
| D�� | Z��ijЩ���������������Ӧ�Ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ����������
ԭ������С��36��X��Y��Z��W����Ԫ�أ�����X�������к�������Ԫ�أ�Yԭ�ӻ�̬ʱ���������������ڲ��������2����Zԭ�ӻ�̬ʱ2pԭ�ӹ������3��δ�ɶԵĵ��ӣ�W��+1�������ӵĺ�����3�����Ӳ��Ҹ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4LNO��NH3�Ļ�������У�������ԭ����Ϊ2NA | |
| B�� | 1molFe����1molˮ������ַ�Ӧת�Ƶĵ�����Ϊ3NA | |
| C�� | ij�¶���10LpH=11��NaOH��Һ�к�OH-����ĿΪNA�����¶��´�ˮ��pH=6 | |
| D�� | ������������������Ϊ1.5NA��NaHSO3��Һ��Ũ��Ϊ0.5mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�1 mol HF�����Ϊ22.4 L | |
| B�� | ���³�ѹ�£�1 mol Na2O2������SO2��Ӧ��ת�Ƶ��ӵ���ĿΪNA | |
| C�� | 1molCl2������Fe��Ӧ��ת�Ƶĵ�����Ϊ2NA | |
| D�� | 5.6 g���������ᷴӦʧȥ�ĵ�����һ��Ϊ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2+Cl2�T2HCl | B�� | 2KMnO4$\frac{\underline{\;\;��\;\;}}{\;}$K2MnO4+MnO2+O2�� | ||
| C�� | CaCO3+2HCl�TCaCl2+H2O+CO2�� | D�� | H2+CuO$\frac{\underline{\;����\;}}{\;}$H2O+Cu |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com