
 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满.分析 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,则X为H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,最外层电子数为4,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对电子,则X原子核外电子排布为1s22s22p6,则Z为N元素;W的+1价阳离子的核外有3个电子层且各层均充满,原子核外电子数为2+8+18+1=29,故W为Cu.
解答 解:原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,则X为H元素;Y原子基态时最外层电子数是其内层电子数的2倍,最外层电子数不超过8,所以内层电子数只能是2,最外层电子数为4,则Y是C元素;Z原子基态时2p原子轨道上有3个未成对电子,则X原子核外电子排布为1s22s22p6,则Z为N元素;W的+1价阳离子的核外有3个电子层且各层均充满,原子核外电子数为2+8+18+1=29,故W为Cu.
(1)Cu+的价电子排布式为:3d10,
故答案为:3d10;
(2)C2H2分子结构式为H-C≡C-H,C原子没有孤对电子,形成2个σ键,杂化轨道数目为2,C原子杂化轨道的杂化类型为sp杂化,1mol C2H2含有σ键的数目为3×6.02×1023个,
故答案为:sp杂化;3×6.02×1023;
(3)化合物NH3分子之间形成氢键,而CH4分子不能,故氨气沸点较高,
故答案为:NH3分子之间形成氢键;
(4)等电子体含有相同原子数目与价电子总数,元素碳的一种氧化物与元素氮的一种氧化物互为等电子体,为CO2与N2O,
故答案为:N2O;
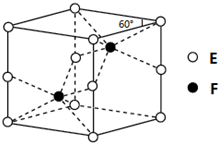
(5)晶胞中黑色球数目为4,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故该氯化物的化学式是CuCl,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为:CuCl+2HCl=H2CuCl3,
晶胞中黑色球与周围的4个白色球形成正四面体结构,在晶胞中最近的2个原子距离是apm,则晶胞体对角线长度为4a pm,则晶胞棱长为$\frac{4a}{\sqrt{3}}$pm,晶胞质量为4×$\frac{99.5}{{N}_{A}}$g,晶胞的密度是4×$\frac{99.5}{{N}_{A}}$g÷($\frac{4a}{\sqrt{3}}$×10-10 cm)3=$\frac{298.5\sqrt{3}}{16{a}^{3}{N}_{A}×1{0}^{-30}}$g•cm-3,
故答案为:CuCl;CuCl+2HCl=H2CuCl3;$\frac{298.5\sqrt{3}}{16{a}^{3}{N}_{A}×1{0}^{-30}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、化学键、氢键、等电子体、晶胞计算等,(5)中关键是计算晶胞棱长,为难点、易错点,需要学生具备一定的数学计算能力,掌握均摊法进行晶胞有关计算.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性 | |
| B. | Y、W的氢化物的稳定性后者强于前者 | |
| C. | X、Y、Z、W形成的简单离子半径大小依次增大 | |
| D. | Z的单质可与X、Y形成的共价化合物反应生成X2单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
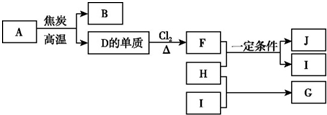 化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.
化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.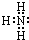 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜检验 | B. | Y有同分异构体 | ||
| C. | M含有两种碳氧共价键 | D. | Y可发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com