
| A. | 标准状况下,1 mol HF的体积为22.4 L | |
| B. | 常温常压下,1 mol Na2O2与足量SO2反应,转移电子的数目为NA | |
| C. | 1molCl2与足量Fe反应,转移的电子数为2NA | |
| D. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA |
分析 A.标准状况下,HF的状态不是气体;
B.过氧化钠与二氧化硫发生氧化还原反应生成硫酸钠;
C.1mol氯气完全反应得到2mol电子;
D.铁与硝酸的反应中,若铁过量,反应生成硝酸亚铁.
解答 解:A.标准状况下,氟化氢为液态,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.常温常压下,1 mol Na2O2与足量SO2反应生成1mol硫酸钠,电子转移了2mol,转移电子的数目为2NA,故B错误;
C.1molCl2与足量Fe反应,转移了2mol电子,转移的电子数为2NA,故C正确;
D.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,若稀硝酸不足,反应生成硝酸亚铁,则0.1molFe完全反应转移了0.2mol电子,转移电子数为0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 向Ca(ClO)2溶液中通入少量SO2Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2═2Fe3++4Br2+10Cl- | |
| D. | 向NH4HCO3溶液中加入足量NaAlO2溶液:NH4++2AlO2-+HCO3--+2H2O═NH3↑+2Al(OH)3↓+CO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
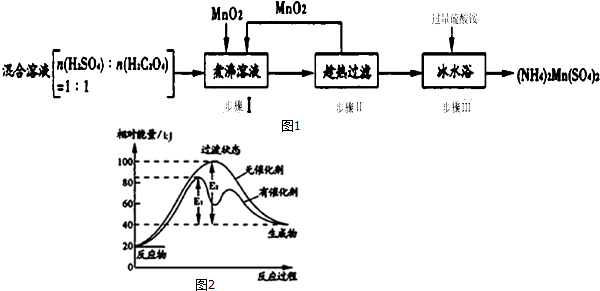
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
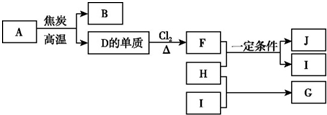 化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.
化合物A是制玻璃的主要原料之一.常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性.D元素是地壳中含量仅次于氧的非金属元素.化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%.上述物质间的转化关系如图所示.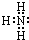 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁金属活泼性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②③④⑤⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
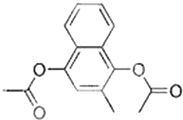 维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )
维生素K4是核酸的组成成分,在体内参与RNA和DNA合成.可用来治疗肿瘤病人因化疗或放疗等引起的白细胞减少.下列有关维生素K4说法正确的是( )| A. | ①②③ | B. | ③④⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在电离只有HCO3-?H++CO32-,H2O?H++OH- | |
| B. | HCO3-的电离程度大于HCO3-的水解程度 | |
| C. | c (Na+)+c (H+)═c (HCO3-)+c (CO32-)+c (OH-) | |
| D. | c (Na+)═c (HCO3-)+c (CO32-)+c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HClO都是弱酸,HClO3、HClO4均为强酸 | |
| B. | HBr的水溶液有酸性、氧化性、还原性 | |
| C. | HI的水溶液还原性很强,在空气中易被氧化变质 | |
| D. | HX水溶液酸性顺序为:HCl>HBr>HI>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com