
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 1 | 2 | 0 |
| 平衡浓度/mol/L | 0.6 | 1.6 | 0.8 |
| A、增大压强使平衡向生成Z的方向移动,平衡常数增大 | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、反应达到平衡时,Y的转化率为20% | ||
| D、改变温度可以改变此反应的平衡常数 |
| 消耗量 |
| 起始量 |
| c2(Z) |
| c(X)?c(Y) |
| 0.82 |
| 0.6×1.6 |
| 2 |
| 3 |
| 0.4mol/L |
| 2mol/L |


科目:高中化学 来源: 题型:
| A、Na+和Mg2+ |
| B、O2-和Mg2+ |
| C、F-和Cl- |
| D、Na+和NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管(图2) | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
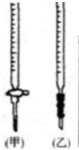
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度 g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| O2,Zn/H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 试验次数 | 起 始 温 度T1/℃ | 终止温度T2/℃ | 平均温度差 (T2-T1)/℃ | ||
| H2SO4 溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
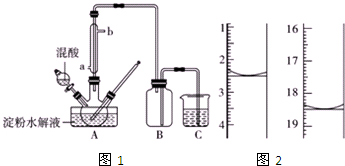 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热,搅拌和仪器固定装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
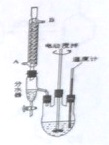 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g?cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂,某实验小组用如图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置已略去).主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g?cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂,某实验小组用如图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置已略去).主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa被完全氧化为Na2O2,失去的电子数为2NA |
| B、常温常压下,16gO3气体含有氧原子数为NA |
| C、常温常压下,22.4LCO2 含有分子数为NA |
| D、18g D2O所含有电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com