
| 温度 试验次数 | 起 始 温 度T1/℃ | 终止温度T2/℃ | 平均温度差 (T2-T1)/℃ | ||
| H2SO4 溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| 4.0+3.9+4.1 |
| 3 |
| 1.3376KJ |
| 0.025mol |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、将氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
| C、在FeI2溶液中通入少量的氯气:2Fe2++Cl2=2Fe3++2Cl- |
| D、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Fe3+ | Cu2+ | Zn2+ |
| 完全沉淀时的pH | 3.2 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 1 | 2 | 0 |
| 平衡浓度/mol/L | 0.6 | 1.6 | 0.8 |
| A、增大压强使平衡向生成Z的方向移动,平衡常数增大 | ||
B、反应可表示为X+Y?2Z,其平衡常数为
| ||
| C、反应达到平衡时,Y的转化率为20% | ||
| D、改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

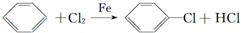
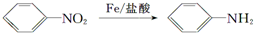 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)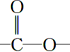 结构.
结构.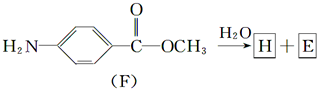
查看答案和解析>>
科目:高中化学 来源: 题型:
| Vρ |
| M |
| M |
| NA△ |
| M |
| NA |
| V |
| NA |
| A、4个 | B、3 个 |
| C、2个 | D、1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
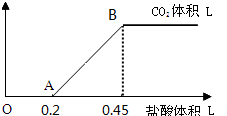
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com