
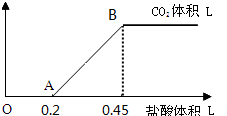
|


科目:高中化学 来源: 题型:
| 温度 试验次数 | 起 始 温 度T1/℃ | 终止温度T2/℃ | 平均温度差 (T2-T1)/℃ | ||
| H2SO4 溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa被完全氧化为Na2O2,失去的电子数为2NA |
| B、常温常压下,16gO3气体含有氧原子数为NA |
| C、常温常压下,22.4LCO2 含有分子数为NA |
| D、18g D2O所含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=8的溶液一定显碱性 |
| B、某反应,其他条件不变,升高温度使化学平衡常数(K)增大,则此反应为放热反应 |
| C、相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③ |
| D、0.1 mol.L-1 的碳酸钠溶液中:c(OH-)=c(H+)-c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
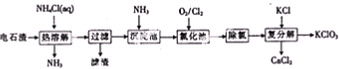
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH) |
| A、中性溶液的AG=0 |
| B、常温下0.lmol/L氢氧化钠溶液AG=12 |
| C、酸性溶液的AG<0 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com