
| A、pH=8的溶液一定显碱性 |
| B、某反应,其他条件不变,升高温度使化学平衡常数(K)增大,则此反应为放热反应 |
| C、相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③ |
| D、0.1 mol.L-1 的碳酸钠溶液中:c(OH-)=c(H+)-c(HCO3-)+c(H2CO3) |


科目:高中化学 来源: 题型:

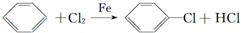
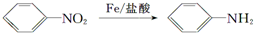 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)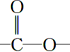 结构.
结构.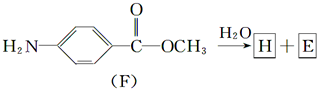
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤时,用玻璃棒搅动漏斗内液体,使之过滤完全 |
| B、燃着的酒精灯打翻失火,应立即用水浇灭 |
| C、配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D、浓硫酸不慎溅到皮肤上,应立即用大量水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
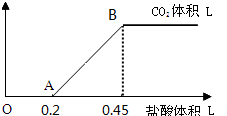
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.7g |
| B、23.4 g |
| C、35.1g |
| D、58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
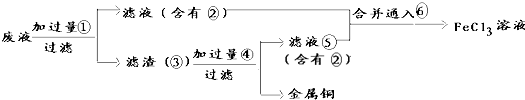
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属阳离子只有氧化性 |
| B、金属氧化物一定是碱性氧化物 |
| C、焰色反应是金属元素的一种化学性质 |
| D、22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com