
【题目】用下列实验装置进行相应实验,装置合理且能达到实验目的的是

A. 装置①:用氯化铵和氢氧化钙制NH3 B. 装置②:收集NO气体
C. 装置③:从饱和食盐水中提取氯化钠 D. 装置④:探究氧化性:KMnO4>Cl2>I2
【答案】D
【解析】
A. 用氯化铵和氢氧化钙固体加热制备氨气时,有水生成;
B. NO与氧气反应;
C.蒸发溶液应用蒸发皿;
D.高锰酸钾能够制备氯气,氯气能够置换碘,以此分析氧化性强弱;
A. 装置①:用氯化铵和氢氧化钙固体加热生成NH3、氯化钙和水,因此大试管应略向下倾斜,以防试管炸裂,A错误;
B. 装置②:NO气体密度比空气略大,易与氧气反应,不能用排空气法收集,B错误;
C. 装置③:从饱和食盐水中提取氯化钠,采用蒸发结晶方法,应该用蒸发皿进行蒸发氯化钠溶液,坩埚用于灼烧固体,C错误;
D. 装置④:锥形瓶中发生反应:2KMnO4+16HCl(浓)= 2MnCl2+2KCl+5Cl2↑+8H2O,所以氧化性:KMnO4>Cl2;烧杯中发生反应为:Cl2+2I-= I2 + 2Cl-,所以氧化性:Cl2>I2;通过比较可以得出氧化性:KMnO4>Cl2>I2,D正确;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】一种工业制备SrCl2·6H2O的生产流程如下图所示:

已知:①M(SrCl2·6H2O)=267 g/mol;
②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;
③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)隔绝空气高温焙烧,若2 mol SrSO4中只有S被还原,转移了16 mol电子。写出该反应的化学方程式:______________________________ 。
(2)过滤2后还需进行的两步操作是_____、_____。
(3)加入硫酸溶液的目的是_____;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_____ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_____。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题:
(1)①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________________ 。
(3)已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
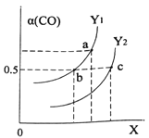
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学校某教师为了让学生观察到明显的实验现象,将教材铜锌单池原电池改为如图所示的双池电池。下列说法不正确的是

A. 铜电极是正极发生还原反应
B. 电池工作过程中甲池中 c(Zn2+)几乎不变
C. 装置中发生的总反应是 Cu2+ + Zn = Cu + Zn2+
D. 电子从锌电极经溶液流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol 电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子都达到了8e-稳定结构,该分子的电子式为____________,化学键类型为________________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com