
| A、具有较强的氧化性 |
| B、在碱中能稳定存在 |
| C、氧元素的化合价均为-1 |
| D、结构式为O-H-O |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
18 8 |
A、 |
B、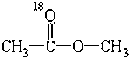 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | 2- 7 |
A、氧化性Cr2
| ||
B、Cr2
| ||
| C、若33.6L SO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol | ||
| D、反应中Fe2(SO4)3 既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象 |
| B、NaOH溶液和AlCl3溶液相互滴加的现象不同 |
| C、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D、Al.Fe.Cu三者对应的氧化物均为碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com