
分析 K2Cr2O7中的Cr元素化合价降低,1mol K2Cr2O7共降低了6价,HCl中Cl元素的化合价升高,产生1mol氯气升高了2价,根据电子守恒,化合价的升降一样,所以Cl2的系数是3,K2Cr2O7的系数是1,其余的根据元素守恒来配平即可.
解答 解:K2Cr2O7中的Cr元素化合价降低,1mol K2Cr2O7共降低了6价,HCl中Cl元素的化合价升高,产生1mol氯气升高了2价,根据电子守恒,化合价的升降一样,所以Cl2的系数是3,K2Cr2O7的系数是1,根据元素守恒,CrCl3的系数是2,KCl的系数是2,HCl的系数是14,所以产物会产生7H2O,
故答案为:1;14;2;3;2;7H2O.
点评 本题考查学生氧化还原反应的配平知识,注意电子守恒定律的应用是关键,难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH | |
| B. | 除去金属离子Cu2+、Hg2+,可向溶液中加入H2S、Na2S等沉淀剂 | |
| C. | 除去某溶液中的SO42-可向溶液中加入镁盐 | |
| D. | 除去ZnCl2溶液中的Fe3+可向溶液中加入ZnO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
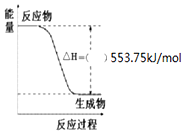 按要求写出298K、101kPa时下列反应的热化学方程式:
按要求写出298K、101kPa时下列反应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
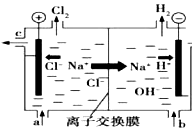 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

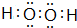 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com