
| A. | 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH | |
| B. | 除去金属离子Cu2+、Hg2+,可向溶液中加入H2S、Na2S等沉淀剂 | |
| C. | 除去某溶液中的SO42-可向溶液中加入镁盐 | |
| D. | 除去ZnCl2溶液中的Fe3+可向溶液中加入ZnO |
分析 A.氨水可与氯化铁反应生成氢氧化铁沉淀,同时生成氯化铵;
B.Cu2+、Hg2+可与H2S、Na2S等反应生成沉淀;
C.硫酸镁溶于水;
D.ZnO可调节pH,促进铁离子水解.
解答 解:A.氨水可与氯化铁反应生成氢氧化铁沉淀,同时生成氯化铵,可用于除杂,故A正确;
B.Cu2+、Hg2+可与H2S、Na2S等反应生成沉淀,可用于除杂,故B正确;
C.硫酸根离子和,镁离子不反应,不能用于除杂,故C错误;
D.ZnO可调节pH,促进铁离子水解,可用于除杂,故D正确.
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
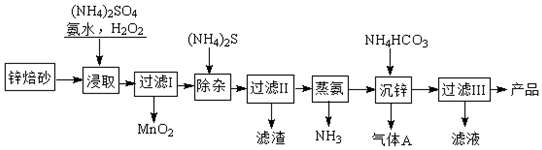
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 保持容积不变,增大CO2的量,NH3的转化率减小 | |
| D. | 降低温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过的知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏打 | 纯净空气 | CaCO3 | 干冰 |
| B | 碘酒 | 漂白粉 | NH3•H20 | Fe |
| C | 明矾 | 铝合金 | 石墨 | 醋酸 |
| D | 盐酸 | CuSO4•5H2O | Na2SO4 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com