
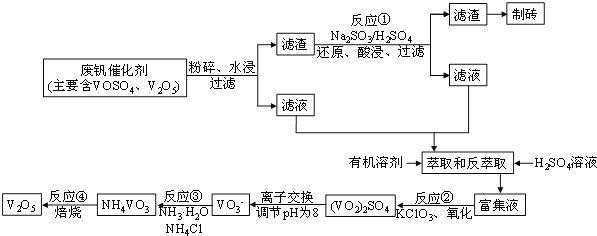
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子交换法回收钒的新工艺,回收率达到91.7%。部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如图所示:
![]()
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示____________,用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是________
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为_________________________
(3)若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O===3(VO2)2SO4+KCl+3H2SO4。若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12︰7,则废钒催化剂中VOSO4 和V2O5的物质的量之比为_____
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式_
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为:_________________
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O![]() V2++VO2++2H+
V2++VO2++2H+
①放电时的正极反应为_______________________
②充电时的阴极反应为______________________
【答案】3V2O5+10Al![]() 6V+5Al2O3 c V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O NH3·H2O 3︰2 NH4+ +VO3﹣===NH4VO3↓ 2VO2+ +H2C2O4+2H+===2VO2+ +2CO2↑+2H2O VO2++2H++e﹣===VO2++H2O V3++e﹣===V2+
6V+5Al2O3 c V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O NH3·H2O 3︰2 NH4+ +VO3﹣===NH4VO3↓ 2VO2+ +H2C2O4+2H+===2VO2+ +2CO2↑+2H2O VO2++2H++e﹣===VO2++H2O V3++e﹣===V2+
【解析】
废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5。
(1)由V2O5冶炼金属钒常用铝热剂法,其化学方程式为3V2O5+10Al![]() 6V+5Al2O3。物质与转移电子关系式为:a.
6V+5Al2O3。物质与转移电子关系式为:a.![]() Fe3O4~
Fe3O4~![]() e-~Fe;b.
e-~Fe;b.![]() Ni2O3~3e-~Ni;c.
Ni2O3~3e-~Ni;c.![]() V2O5~5e-~V;d.MnO2~4e-~Mn,由得失电子守恒可知,用铝热剂法从各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c;
V2O5~5e-~V;d.MnO2~4e-~Mn,由得失电子守恒可知,用铝热剂法从各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c;
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5转化为可溶性的VOSO4,便于提纯,则反应①的化学方程式为V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O;
(3)若反萃取使用硫酸用量过大,就需要用碱来中和,据流程图可知,进一步处理会增加NH3·H2O的用量,造成成本增大;
(4)假设两步所用试剂Na2SO3与KC1O3的物质的量为12mol:7mol,分别据两个方程式:
Na2SO3 + V2O5 + 2H2SO4 = 2VOSO4 + Na2SO4 + 2H2O
12mol 12mol 24mol
KClO3+6VOSO4+3H2SO4═3(VO)2(SO4)3+KCl+3H2O
7mol 42mol
该催化剂中VOSO4的物质的量为42mol-24mol=18mol,因此该催化剂中VOSO4、V2O5的物质的量之比为 18mol:12mol=3:2;
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,反应的离子方程式为NH4+ +VO3﹣===NH4VO3↓;
(6)用酸化的H2C2O4溶液滴定(VO2)2
(7)①正极反应是还原反应,由电池总反应可知放电时的正极反应为VO2++2H++e﹣===VO2++H2O;
②充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,电极反应为V3++e﹣===V2+。


科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是( )
A. 少量CO2通入NaClO溶液中:CO2 + H2O + 2ClO-===CO32-+ 2HClO
B. 少量的SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO-===CaSO3↓+2HClO
C. 少量的SO2通入Na2CO3溶液中:SO2 + H2O + 2CO32-===SO32-+ 2HCO3-
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H+ + HCO3-===CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、NH4+、Cl-、H+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加足量NaOH溶液加热后,收集到气体0.04mol。
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验数据,填写下列空白。
(1)一定不存在的离子有_________。
(2)第②步操作发生反应的离子方程式为_________。
(3)第③步操作确定的离子有_________。
(4)无法确定是否存在的离子是_________,若满足n(K+)________0.02mol(填“>”、“<”或“=”)时,能确定其存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
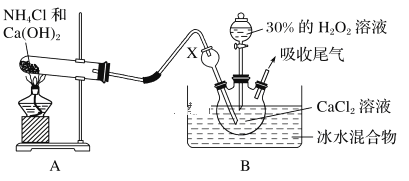
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
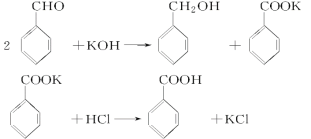
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
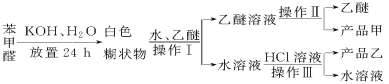
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
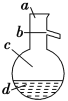
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,收集产品甲的适宜温度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com