
【题目】下列图像与对应的叙述相符的是
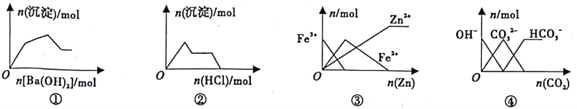
A. 图①表示向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
B. 图②表示向NaAlO2溶波中逐滴加入盐酸
C. 图③表示向FeCl3溶液中加入锌粉
D. 图④表示向NaOH溶液通入CO2
【答案】C
【解析】A、向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液,先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成BaSO4的同时Al(OH)3溶解(此时生成沉淀的物质的量逐渐减少),最后Al(OH)3完全溶解,只剩余BaSO4沉淀,先生成沉淀至Al3+沉淀完毕,后减小,最后不变,叙述与示意图不相符,选项A错误;B、向NaAlO2溶液中逐滴加入盐酸,先生成沉淀,后溶解,叙述与示意图不相符,选项B错误;C、向FeCl3溶液中加入锌粉,发生反应为2Fe3++Zn=2Fe2++ Zn2+,Zn+ Fe2+=Fe+ Zn2+,C选项图像正确;D、向NaOH溶液通入CO2,发生反应为2OH-+CO2=CO32-+H2O,CO32-+ CO2+H2O=2HCO3-,当溶液里OH-完全反应时所得CO32-浓度为原OH-的物质的量的![]() ,选项D图像错误。答案选C。
,选项D图像错误。答案选C。


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】铁是生活中的一种常见金属,用途非常广泛。
(1)FeCl3溶液用于腐蚀铜制印刷电路板,发生反应的离子方程式为___________。
(2)废铁皮制取铁红粉的局部流程图如下:
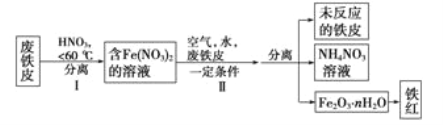
①步骤1温度不能太高的原因是____________________________。
②步骤Ⅱ中发生反应:
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
第一个反应的氧化剂是___________,氧化产物是____________。第二个反应每生成1 molNH4NO3,转移的电子数是_________。
③铁红可用于焊接钢轨,其反应的化学方程式为_______________。
④上述生产结束后,流程中氮元素最主要的存在形式为__________(填字母)。
A.氮氧化物 B.硝酸铵 C.硝酸亚铁 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1L 0.1mol?L﹣1的NaHCO3溶液中HCO ![]() 和CO
和CO ![]() 离子数之和为0.1NA
离子数之和为0.1NA
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于煤、石油、天然气等资源的说法正确的是( )
A. 石油裂解得到的汽油是纯净物
B. 石油产品都可用于聚合反应
C. 天然气是一种清洁的化石燃料
D. 水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是( )
A.5ν(NH3)=4ν(O2)
B.5ν(O2)=6ν(H2O)
C.2ν(NH3)=3ν(H2O)
D.5ν(O2)=4ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
(1)f在元素周期表的位置是 .
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:>> . (用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为 . (填序号)A.MnO2B.FeCl3C.Na2SO3D.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:  ①X溶液与Y溶液反应的离子方程式为
①X溶液与Y溶液反应的离子方程式为
②常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL 1molL﹣1 R溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:
①写出m点反应的离子方程式 .
②若R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙呈红色的溶液中:Na+、AlO ![]() 、NO
、NO ![]() 、CO
、CO ![]()
B.由水电离产生的c(H+)=10﹣12mol?L﹣1的溶液:NH4+、SO ![]() 、HCO
、HCO ![]() 、Cl﹣
、Cl﹣
C.含有0.1 mol?L﹣1 HCO3﹣的溶液:Na+、Fe3+、NO ![]() 、SCN﹣
、SCN﹣
D.![]() =0.1 mol?L﹣1的溶液:Na+、K+、CO
=0.1 mol?L﹣1的溶液:Na+、K+、CO ![]() 、NO
、NO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com