
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____

(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
【答案】 Fe+Cu2+==Cu+Fe2+ 0.25 2H++2e- == H2↑或 2NH4++2e-==H2↑+2NH3 酸 NH4++H2O![]() NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
【解析】试题分析:本题考查原电池原理和电解池原理,电化学的有关计算。
(1)Fe为负极,Fe极的电极反应式为Fe-2e-=Fe2+,石墨为正极,石墨极的电极反应式为Cu2++2e-=Cu,反应的离子方程式为Fe+Cu2+=Fe2++Cu。若反应前两电极质量相等,根据电子守恒,电路中每通过2mol电子,负极减少1molFe(56gFe),正极增加1molCu(64gCu),即电路中每通过2mol电子,两极质量相差56g+64g=120g,则两极质量相差15g时导线中通过的电子为![]() 2mol=0.25mol。
2mol=0.25mol。
(2)若将CuCl2溶液换为NH4Cl溶液,石墨为正极,石墨电极的电极反应式为2H++2e-=H2↑(或2NH4++2e-=H2↑+2NH3)。NH4Cl属于强酸弱碱盐,由于NH4+的水解,NH4Cl溶液呈酸性,NH4+水解的离子方程式为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,此时甲装置为原电池,乙装置为电解池,由于Fe比Cu活泼,甲装置中Fe为负极,Cu为正极,则乙装置中的石墨(1)为阴极,石墨(2)为阳极。甲装置中溶液为NaCl溶液,溶液呈中性,甲为铁的吸氧腐蚀,Cu极的电极反应式为O2+4e-+2H2O=4OH-。
(4)如图2乙装置中改为加入400mL CuSO4溶液,装置乙中电解的离子方程式为2Cu2++2H2O![]() 2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=
2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=![]() =0.02mol,则反应生成n(H+)=0.04mol,c(H+)=
=0.02mol,则反应生成n(H+)=0.04mol,c(H+)=![]() =0.1mol/L,溶液的pH=-lgc(H+)=1。
=0.1mol/L,溶液的pH=-lgc(H+)=1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应除了生成新的物质外,只伴随着热量的变化
B.物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生
C.太阳能、氢能、生物质能属于新能源
D.化石燃料是一次能源,乙醇是不可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
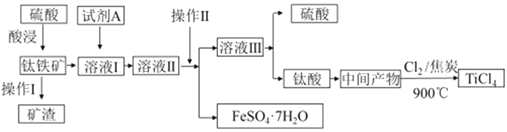
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏伽德罗常数,下列物质的物质的量最小的是
A. 标准状况下 2.24L O2 B. 含 NA 个氢原子的 H2
C. 22g CO2 D. 含 1.204×1024 个分子的 CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是( )
A.磁性氧化铁可用作红色油漆和涂料
B.漂白粉可用于生活用水的消毒
C.小苏打可用于中和过多胃酸
D.硅胶可用作袋装食品的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数Kb=1.6×10-4)。下列说法正确的是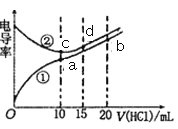
A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mL
B. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<b
C. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少
D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种元素 A、B、C、D,其中 B2-离子与 C+离子核外都有二个电子层,B 原子的质子数与 C 原子的 质子数之和等于 D 原子的质子数,A 原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D 的元素符号分别为____、____、____、____。
(2)B2-的电子式 ________,D 原子的原子结构示意图为____,B 与 C 形成的简单化合物的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com